硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:

已知:某些氢氧化物沉淀的pH如下表所示:
| 氢氧化物 |
开始沉淀时的pH |
完全沉淀时的pH |
| Mg(OH)2 |
9.3 |
10.8 |
| Fe(OH)2 |
7.6 |
9.6 |
| Fe(OH)3 |
2.7 |
3.7 |
| Al(OH)3 |
3.7 |
4.7 |
根据题意回答第(1)~(6)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:______、_____。
(2)加入的NaClO可与Mn2+反应:Mn2+ + ClO- + H2O = MnO2↓ + 2H+ + Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为 。
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(4)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩, 。“操作I”是将滤液继续蒸发浓缩,冷却结晶, ,便得到了MgSO4·7H2O。
(5)实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为172.2 g,计算MgSO4·7H2O的产率为 (保留两位有效数字)。
(6)金属镁可用于自然水体中铁件的电化学防腐,完成下图防腐示意图,并作相应标注。

在一密闭容器中反应2SO2+O2 2SO3经5秒后,SO3的浓度增加了0.4mol·L-1,则在这段时间内用O2表示的反应速率为mol·L-1·s-1。
2SO3经5秒后,SO3的浓度增加了0.4mol·L-1,则在这段时间内用O2表示的反应速率为mol·L-1·s-1。
已知A、B、C、D、E、F是短周期中的6种非金属元素,它们的原子序数依次增大。A元素是周期表中半径最小的元素, B原子的最外层上有4个电子;C与D在周期表中处于相邻的位置,D的阴离子和E的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体Y;F的L层电子数等于K、M两个电子层上电子数之和
(1)请写出元素符号:
ABCDE F
(2)画出F的阴离子的结构示意图
(3)A单质和C单质在一定条件下反应生成化合物X,该反应的化学方程式为
向X的水溶液中滴入酚酞溶液,会观察到
(4)写出E在D的单质中点燃,生成固体Y化学方程式
(5)将12gB单质在足量的D单质中燃烧,所得气体通入1L 1mol/L NaOH溶液中,完全吸收后,溶液中大量存在的离子是。(相对原子质量:C—12)
请根据反应Fe+CuSO4==Cu+FeSO4设计一个原电池,画出装置图
下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
|||||
| 3 |
B |
C |
J |
F |
H |
I |
(1)表中元素,化学性质最不活泼的是,只有负价而无正价的元素是, 可用于制半导体材料的元素是_______
(2)C元素在元素周期表中的位置是周期族。
(3)最高价氧化物的水化物碱性最强的是,酸性最强的是,呈两性的是;
(4)A分别与E、G、H形成的化合物中,最稳定的;
(5)在B、C、E、F中,原子半径最大的是.
(6)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式。
(7)B、H两种元素形成的化合物所含的化学键类型为
(8)写出C的最高价氧化物与H的氢化物之间反应的离子方程式_________________。
加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。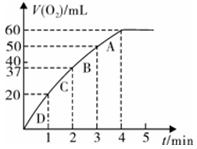
①写出H2O2在二氧化锰作用下发生反应的化学方程式。
②实验时放出气体的总体积是mL。
③放出1/3气体所需时间为min。
④反应放出3/4气体所需时间约为min。
⑤A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
⑥解释反应速率变化的原因。
⑦计算H2O2的初始物质的量浓度_____________。(请保留两位有效数字)