运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据图回答下列问题:

①2SO2(g)+O2(g) 2SO3(g)的△H________0(填“>”或“<”),
2SO3(g)的△H________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是________。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
1mol有机物能与1mol氢气发生加成反应,产物是2,2,3-三甲基戊烷,此有机物的结构简式可能有。
乙烯燃烧的化学方程式是______________________,乙烯燃烧火焰比甲烷燃烧的火焰要明亮的原因是________________________________。
某烃A、B的分子式均为C6H10,它们的分子结构中无支链或侧链。
(1)A为环状化合物,它能与Br2发生加成反应,A的名称是________。
某烯烃1 mol与H2加成后产物为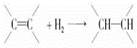 ,则原烯烃可能的结构简式为________________________。
,则原烯烃可能的结构简式为________________________。
CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是________。
(2)120 ℃、101 kPa下,a mL由CO、CH4组成的混合气体在b mL O2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为____________(保留2位小数)。
②若燃烧后气体体积缩小了a/4 mL,则a与b关系的数学表示式是_____________。