【化学——选修3:物质结构与性质】目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:

(1)基态铜原子的外围电子排布式为__________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是________,其立体结构是_______。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液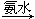 蓝色沉淀
蓝色沉淀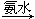 沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_____________;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_____________;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
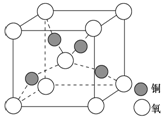
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为_____________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________pm。((用含d和NA的式子表示)。
(18分)为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:
(1)3种试剂的化学式:A________,B________,C________。
(2)加过量A的原因是____________,
有关反应的化学方程式为__________________________ _________________________
(3)加过量B的原因是____________,
有关反应的化学方程式为
(Ⅰ)A、B、C三种无色可溶性盐分别是由Na+、Ag+ 、Ba2+、Cl—、NO3— 、CO32—中不同的阴、阳离子所组成。经实验A溶液、B溶液均可以与盐酸反应,其中A产生白色沉淀,B产生气泡。则A为、B为。将B和C的溶液混合反应的化学方程式为:。
(Ⅱ)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:
从实验可以判断,该固体粉末中一定不含有,
它的组成可能是或。
下列各组物质的分离或提纯,应选用下述方法的哪一种?(填序号)
| A.分液 | B.过滤 | C.萃取 | D.蒸馏 E、结晶 F、加热分解 |
(1)除去Ca(OH)2溶液中悬浮的 CaCO3;
(2)从碘水中提取碘;
(3)用自来水制取蒸馏水;
(4)分离植物油和水;
(5)除去 NaCl 中所含的少量 KNO3;
(6)除去 KCl 中少量 KClO3。
(4分)为了达到下表所列的实验目的,请选择合适的实验方法,将其标号填在相应的空格中。
(6分)简要回答下列问题。
(1)“可燃冰”是天然气的水合物,外形似冰,它的主要可燃成分是甲烷,写出甲烷燃烧的化学方程式。
(2)氢氧化铝Al(OH)3是一种治疗胃酸(含盐酸)过多的药物,请用化学方程式表示该反应的原理:。
(3)蒸馒头时,经常往蒸笼中放入小苏打,使得馒头膨松,食用起来香甜可口,请写出其原因:。