下列实验中,依据实验操作及现象,得出的结论正确的是
| |
操 作 |
现 象 |
结 论 |
| A |
测定等浓度的Na2CO3和Na2SO4 溶液的pH |
前者pH比后者的大 |
非金属性: |
| B |
将一片铝箔置于酒精灯外焰上灼烧 |
铝箔熔化但不滴落 |
铝箔表面有致密Al2O3薄膜,且Al2O3熔点低于Al |
| C |
向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 |
生成白色沉淀 |
溶液X中一定含有 或 或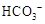 |
| D |
取久置的Na2O2粉末,向其中滴加过量的盐酸 |
产生无色气体 |
Na2O2没有变质 |
下列叙述正确的是()
| A.浊液均可用过滤的方法进行分离 |
| B.因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3 |
| C.向一定体积的热浓硫酸中加入过量的铁粉,生成的气体不能完全被烧碱溶液吸收 |
| D.将某铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,说明该铝热剂中一定不含Fe2O3 |
化学与社会、生产、生活紧密相关。下列说法正确的是()
| A.含有硫酸的工业废水用硝酸钡处理后再排放有利于减少水体污染 |
| B.高锰酸钾溶液、酒精、双氧水均能杀菌消毒,都是利用其强氧化性 |
| C.碳酸氢铵俗称“臭粉”,受热易分解放出氨气和二氧化碳,可用于制作糕点时的膨松剂 |
| D.铝制饭盒因其表面能形成致密的氧化膜,故可用于长时间存放酸性或碱性的食物 |
3.04g铜镁合金完全溶解于含1.4molHNO3的浓HNO3中,得到NO2和N2O4混合气2240mL(标准状况下).向反应后的溶液中加入2mol•L﹣1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀,下列说法不正确的是()
①该合金中镁与铜的物质的量之比为1:2
②NO2和N2O4的混合气体中,N2O4的体积分数为80%
③得到5.08g沉淀时,加入NaOH溶液的体积是620mL
④该反应中共转移电子为1.2NA.
| A.③ | B.②③④ | C.①③ | D.①②③④ |
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( )
| A.K3C60中只有离子键 | B.K3C60中不含共价键 |
| C.该晶体在熔融状态下能导电 | D.C60与12C互为同素异形体 |
现有短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍。下列说法正确的是
| A.简单阳离子的氧化性:Y>X |
| B.气态氢化物的稳定性:Z>M |
| C.等浓度X2Z与Y2Z的溶液中,水的电离程度:X2Z>Y2Z |
| D.简单离子半径由大到小的顺序是:Z>M>Y |