某学生鉴定甲盐的流程如图所示,下列说法正确的是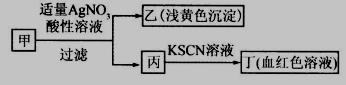
| A.如果甲中含有S2-,则乙是硫磺沉淀 |
| B.如果乙是AgCl沉淀,那么甲是FeCl3 |
| C.丙中肯定含有Fe3+,所以甲是FeBr2 |
| D.甲中含有铁元素,可能显示+2或者+3价 |
下列说法正确的是
| A.35Cl原子所含质子数为18 |
| B.0.1 mol HCl所含分子数约为6.02×1022 |
| C.3.5 g的35Cl2气体的体积为2.24 L |
| D.2 mol 35Cl2气体的质量为140 g |
在下列物质之间的反应中,水既不是氧化剂又不是还原剂的是
| A.F2 + H2O (生成O2和HF) | B.Na + H2O |
| C.NaH + H2O(生成H2和NaOH) | D.Na2O2 + H2O |
下列反应既是离子反应,又是氧化还原反应的是
| A.氯化钠溶液中滴入硝酸银溶液 | B.氢气还原氧化铜 |
| C.铁片置于硫酸铜溶液中 | D.一氧化碳的燃烧 |
下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是
| X |
Y |
Z |
|
| A |
NaHCO3溶液 |
Na2CO3 |
通入过量的CO2 |
| B |
FeCl3溶液 |
CuCl2 |
Fe |
| C |
Fe2O3 |
Al2O3 |
盐酸 |
| D |
Na2SO4溶液 |
Na2CO3 |
BaCl2溶液 |
下列关于金属铝及其化合物的叙述正确的是
| A.Al在常温下不能与O2反应 |
| B.Al与HCl或NaOH溶液反应都能放出H2 |
| C.Al在化学反应中容易失去电子,是氧化剂 |
| D.Al2O3只能与酸反应,不能与碱反应 |