铁氧体(Fe3O4)法是处理含铬废水的常用方法.其原理是:用FeSO4把废水中Cr2O72-还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3·FeO)的复合氧化物 。 处理含1 mol Cr2O72-废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是
。 处理含1 mol Cr2O72-废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是
| A.x=1,a=5 | B.x=0.5,a=8 |
| C.x=2,a=10 | D.x=0.5,a=10 |
铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。Tl3+与Ag在酸性介质中发生反应:Tl3++2AgTl++2Ag+。下列推断正确的是( )
| A.Tl+的最外层有1个电子 |
| B.Tl3+的氧化性比Al3+弱 |
| C.Tl能形成+3价和+1价的化合物 |
| D.Tl+的还原性比Ag强 |
某500 mL溶液中含0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变) ( )
| A.0.4 mol·L-1 | B.0.6 mol·L-1 |
| C.0.8 mol·L-1 | D.1.0 mol·L-1 |
有六种溶液,分别含有下列阳离子:Cu2+、Fe2+、Fe3+、Al3+、NH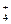 、Na+,只选用一种试剂将它们一一鉴别,该试剂可以是( )
、Na+,只选用一种试剂将它们一一鉴别,该试剂可以是( )
| A.AgNO3溶液 | B.KMnO4溶液 |
| C.稀氨水 | D.NaOH溶液 |
类似于Fe3O4,铅也有化学式为Pb3O4的氧化物。以下说法正确的是( )
①Pb3O4里Pb的化合价为+2和+3②Pb3O4里Pb的化合价为+2和+4③Pb3O4的化学式还可以表示为PbO·Pb2O3④Pb3O4的化学式还可以表示为2PbO·PbO2
| A.①③ | B.②③ | C.①④ | D.②④ |
铝能用于作铝热剂和冶炼难熔金属的原因是( )
| A.铝的导热性很好 |
| B.在高温下能燃烧 |
| C.还原性较强且在反应中放出大量的热 |
| D.金属性较强 |