下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
| A.取ag混合物充分加热,剩余bg固体 |
| B.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg |
| C.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体 |
| D.取ag混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得bg固体 |
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO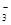 +3HSO
+3HSO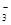 ===3SO
===3SO +Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快。下图为用ClO
+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快。下图为用ClO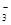 在单位时间内的物质的量浓度的变化来表示该反应的速率一时间图象。下列说法不正确的是( )
在单位时间内的物质的量浓度的变化来表示该反应的速率一时间图象。下列说法不正确的是( )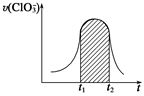
| A.反应开始时速率增大可能是c(H+)增大引起的 |
| B.纵坐标为v(H+)的速率—时间曲线与图中曲线能完全重合 |
| C.后期反应速率下降的主要原因是反应物的浓度减小 |
D.图中的阴影部分“面积”为t1~t2时间内ClO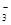 的物质的量浓度的减小值 的物质的量浓度的减小值 |
燃料电池是燃料(如H2、CO、CH4等)跟氧气或空气起反应,将化学能转变为电能的装置,电解液为强碱溶液。下列关于甲烷燃料电池的说法正确的是()
| A.负极反应为CH4+10OH-→CO32-+7H2O+8e- |
| B.负极反应为O2+2H2O+4e-→4OH- |
| C.随着放电进行,溶液中的阳离子向负极移动 |
| D.随着放电进行,溶液的PH不变 |
下列关于化学反应限度的说法正确的是( )
| A.当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度 |
| B.当一个可逆反应进行到平衡状态时,这个反应的正向反应速率和逆向反应速率相等 |
| C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变 |
| D.化学反应的限度不可以通过改变条件而改变 |
一定条件下,对于可逆反应X(g)+3Y(g) 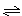 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
| A.c1∶c2=3∶1 | B.平衡时,Y和Z的生成速率之比为2∶3 |
| C.X、Y的转化率相等 | D.c1的取值范围为0.04 mol/L<c1<0.14 mol/L |
在2L密闭容器中进行的反应2SO2(g)+O2(g) 2SO3(g),在10秒内反应物SO2的物质的量由1mol降到0.6mol,则反应速率ν(O2)为()
2SO3(g),在10秒内反应物SO2的物质的量由1mol降到0.6mol,则反应速率ν(O2)为()
| A.0.02mol/(L·s) | B.0.04mol/((L·s) | C.0.01mol/((L·s) | D.0.2mol/((L·s) |