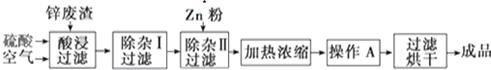
(13分)工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质,并用来生产ZnSO4·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的pH如下表。
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
5.4 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
8.0 |
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有________。
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是_____。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为______。为控制上述pH范围可选择加入的试剂或药品是________。
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)在“除杂Ⅱ”步骤中,加入Zn粉的作用是_______。“操作A”的名称是_______。
(4)常温下,已知Ksp〔Cu(OH)2〕=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于___________。
在热的稀硫酸溶液中溶解了11.4 g FeSO4 ,当加入50 mL 0.5 mol / L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
(1)推算出x=_________,y= _________
(2)配平该化学方程式(化学计量数填写在上式方框内)
(1)用18mol·L-1的硫酸配制1.00 mol·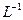 的硫酸100mL。若实验仪器有:
的硫酸100mL。若实验仪器有:
A.100mL量筒、B.托盘天平、C.玻璃棒、D.50mL容器瓶、E. 10mL量筒、
F.胶头滴管、G. 50mL烧杯、H. 100mL容量瓶。
实验时应选用仪器是(填 字母);
字母);
(2)在容量瓶的使用方法 中,下列操作不正确的是(填字母);
中,下列操作不正确的是(填字母);
A.使 用容量瓶前检查其是否漏水。
用容量瓶前检查其是否漏水。
B.容量瓶用蒸馏水洗净后,再用待配溶液洗涤。
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1—2cm处,用胶头滴管滴加蒸馏水到刻度线。
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1—2cm处,用胶头滴管滴加蒸馏水到刻度线。
E.盖好瓶盖,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
(3)浓H2SO4稀释时应该
;
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响?(填“偏高”、“偏低”或“不变”)
①稀释硫酸后的烧杯未洗涤:;
②未经冷却趁热将溶液注入容量瓶中:;
③摇匀后发现液面低于刻度线再加水:;
④容量瓶中原有少量蒸馏水:。
某混合物的水溶液中,只可能含有以下离子中的若干种 :K+、Mg2+、Fe3+、Al3+、NH4+、Cl-、CO32-和SO42-。现每次取10
:K+、Mg2+、Fe3+、Al3+、NH4+、Cl-、CO32-和SO42-。现每次取10 0.00mL进行实验:(已知NH4++OH-= NH3↑+H2O)
0.00mL进行实验:(已知NH4++OH-= NH3↑+H2O)
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后,整个过程没有沉淀产生,加热,收集到气体0.896L(标准状况下)
②第三份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。
请回答:
(1)c(CO32-)=______;
(2)K+是否存在?_____________;若存在,浓度至少是_________________
(若不存在,则不必回答第(2)问);
(3)根据以上实验,不能判断哪种离子是否存在?若存在,这种离子如何进行检验?
__________________________________________________________________________________________________________________________________________。
已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下
3Cu + 8HNO3 =3Cu(NO3)2 + 2NO↑+ 4H2O
(1)用双线桥法分析上述反应(只需标出电子得失的方向和数目)
(2)上述反应中氧化剂是,氧化产物是 ;
;
(3)硝酸在反应过程中起的作用是、;
硝酸没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸占总硝酸的;
(4)若反应中转移了0.6mol电子,产生的气体在标准状况下的体积是
。
A、B、C、D、E 5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3中的一种。已知:
①、A与B反应有气体生成; ②、B与C反应有沉淀生成;
③、C与D反应有 沉淀生成; ④、D与E反应有沉淀生成;
沉淀生成; ④、D与E反应有沉淀生成;
⑤、A与E反应有气体生成;
⑥、 ②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在反应③中,生成的沉淀物质的化学式是;
(2)B是, D是(填化学式);
(3)反应⑤的离子方程式是。