【化学—化学与技术】甲酸钠广泛用作催化剂、稳定合成剂、印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。甲酸钠用电石炉废气(75%~90%CO,以及少量CO2、H2S、N2、CH4等)合成,其合成部分工艺流程如下: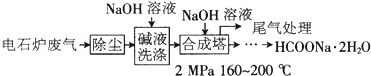
(1)上述工艺用碱液洗涤的目的是___________,可能发生的反应有_______(写两个化学方程式)。
(2)上述合成工艺中采用循环喷射吸收合成,其目的是_________;最后尾气主要成分是______。
(3)甲酸钠高温时分解制取草酸钠(Na2C2O4)的化学方程式为________。
(4)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为____________。
(5)某厂测知合成塔中甲酸钠生产产率为40%,要制得溶质质量分数为5%的HCOONa溶液1吨,需要CO在标况下的体积为___________。
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q184.8kJ(填“>”、“<”或“=”)。一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是。
a.3v逆(N2)=v正(H2)b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为
2NH3 (g)+ CO2 (g) CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)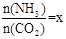 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是。
(3)图中的B点处,NH3的平衡转化率为。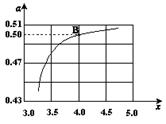
(4)已知: 3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
完成并配平下列氧化还原反应方程式:12Cl2+15NH3→――③
V、W、X、Y、Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素,Y、Z组成的气态化合物M的水溶液呈碱性,W的单质在X2中燃烧产物可使品红溶液褪色,V是一种历史悠久、应用广泛的金属元素。请回答:
(1)Y元素在周期表中的位置是;写出X、Z两种元素组成的化合物Z2X2的一种用途:。
(2)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且反应属于氧化还原反应,请写出该反应的化学方程式。
(3)X、Y、Z三种元素可组成一种强酸U,M在适当条件下被U吸收生成一种盐。该盐的水溶液的pH7(填“大于”、“小于”或“等于”)。原因是(用离子方程式表示)
(4)若将V金属投入到盐酸中,生成了浅绿色溶液N。N的酸性溶液与双氧水反应的离子方程式:
(5)有人设想寻求合适的催化剂和电极材料,以Y2、Z2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式;放电时溶液中H+移向(填“正”或“负”)极。
聚碳酸酯无色透明,具有优异的抗冲击性,能用于制造宇航员的面罩、智能手机机身外壳等。双酚化合物是合成聚碳酸酯的单体之一,某种双酚化合物G的合成路线如下:
(1)G中所含的官能团有________________;B的核磁共振氢谱有个峰。
(2)写出反应类型:反应 ① ___________;反应 ③ ____________。
(3)写出A的名称 ______________;F的结构简式 ______________。
(4)写出反应 ④ 的化学方程式_______________________________________。
(5)C有多种同分异构体,写出同时满足下列条件的同分异构体的结构简式_____________。
(I)属于α-氨基酸,且苯环上有三个互为间位的取代基
(II)与FeCl3溶液作用无显色现象
(III)1 mol该同分异构体与足量NaOH溶液反应时,最多能消耗3 mol NaOH
铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下: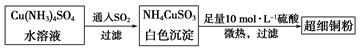
①NH4CuSO3中金属阳离子的核外电子排布式为。N、O、S三种元素的第一电离能大小顺序为(填元素符号)。
②Cu(NH3)4SO4中所含的化学键有
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。根据等电子体原理,CO分子的结构式为。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为。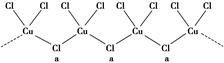
(4)Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密度为g·cm-3(用NA表示阿伏加德罗常数的数值)。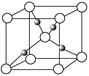
1862年,比利时化学家索尔维发明了氨碱法制碱,1926年,我国化学家侯德榜创立了
更为进侯德榜制碱法,也叫联合制碱法,两种制碱的生产流程可简要表示如下图: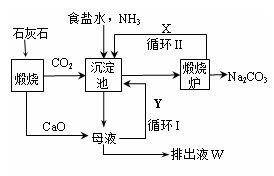
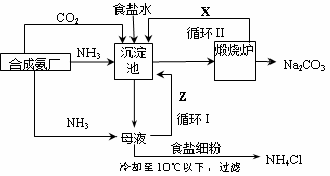
氨碱法生产流程联合制碱法生产流程
(1)向沉淀池中通入CO2和氨气时,应先通入氨气的原因是。
(2)沉淀池中发生反应的化学反应方程式是 从沉淀池中分离沉淀的操作是。
(3)氨碱法生产流程示意图中的Y是,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为 。
(4)联合制碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是(选填编号)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度, 使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联合制碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联合制碱法的另一项优点是。
(6)产品纯碱中含有碳酸氢钠,可以用加热分解的方法测定产品中纯碱的质量分数,已知样品质量为ag,加热至质量不再改变时称重为bg,则纯碱的质量分数为。