氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q 184.8kJ(填“>”、“<”或“=”)。一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是 。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为
2NH3 (g)+ CO2 (g) CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)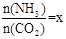 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
(3)图中的B点处,NH3的平衡转化率为 。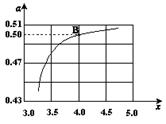
(4)已知: 3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
完成并配平下列氧化还原反应方程式:12Cl2+15NH3→ ――③
(17分)运用化学反应原理研究溶液的组成与性质具有重要意义。请回答下列问题:
(1)用惰性电极电解含有NaHCO3的NaCl溶液,假设电解过程中产生的气体全部逸出,测得溶液pH变化如图所示。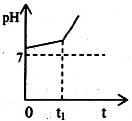
则在0→t1时间内,阳极反应式为,溶液pH升高比较缓慢的原因是(用离子方程式回答)。
(2)含氨废水易引发水体富营养化。向NH4Cl溶液中加入少量NaOH固体,
溶液中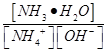 ______________(填“增大”“减小”或“不变);25℃时,NH3·H2O的电离平衡常数Kb=1.8×10—5mol·L—1,该温度下,1 mol·L—1的NH4Cl溶液中c(H+)="________________" mol
______________(填“增大”“减小”或“不变);25℃时,NH3·H2O的电离平衡常数Kb=1.8×10—5mol·L—1,该温度下,1 mol·L—1的NH4Cl溶液中c(H+)="________________" mol L
L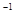 。(已知
。(已知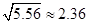 )
)
(3)如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式。
(4)某工业生产中,向含有大量Ca2+、Mn2+的溶液中加入足量NH4HCO3,生成MnCO3沉淀和CO2,写出该反应的离子方程式,剩余溶液中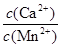 <。
<。
[已知Ksp(MnCO3)=1×10-11(mol·L-1)2,Ksp(CaCO3)="5" ×10-9(mol·L-1)2]
氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、 脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g)△H1=-574 kJ·mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g)△H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图所示。
则0~10 min内,氢气的平均反应速率为_______mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡(填“正向”、“逆向”或“不”)移动。
(3)脱硫。利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得。NaOH溶液吸收SO2的过程中,pH随n(SO32-)︰n(HSO3﹣)变化关系如下表:
| n(SO32﹣)︰n(HSO3﹣) |
91︰9 |
1︰1 |
9︰91 |
| pH |
8.2 |
7.2 |
6.2 |
①由上表判断,NaHSO3溶液显性,用化学平衡原理解释:。
②当溶液呈中性时,离子浓度关系正确的是(选填字母):。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+) > c(HSO3-) > c(SO32-) > c(H+) = c(OH-)
c.c(Na+) + c(H+) = c(SO32-) + c(HSO3-) + c(OH-)
(4)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有 生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
铵盐在工农业生产中有着重要的用途,请根据要求完成下列各题。
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。
(1)仪器连接的顺序(用接口序号字母表示)是:a
(2)试从电离平衡角度分析该实验装置A中能产生氨气的原因:。
(3)将装置C中两种液体分离开的操作名称是。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为。
(2)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,二是。
(3)由MgCl2溶液得到MgCl2·6H2O晶体,操作为、 、
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:。
②由MgCl2·6H2O加热制备无水MgCl2的操作在氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+ O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+ O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。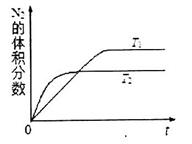
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。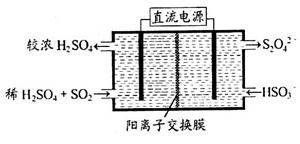
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)以H2O2和硼氢化合物NaBH4(B的化合价为+3价)作原料的燃料电池,可用作电解池的电源。其工作原理如图所示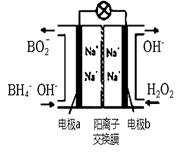
①写出a极上的电极反应式:,
②正极材料采用MnO2,MnO2除了作电极材料之外还可能具有的作用为
某工业废水中含有CN-和Cr2O72—等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理: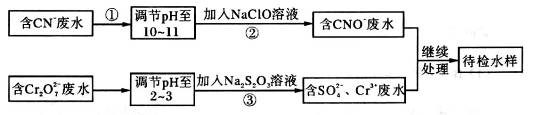
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为________________。
(2)步骤③的反应为S2O32—+ Cr2O72—+H+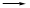 SO42—+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72—转移__________mol e-。
SO42—+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72—转移__________mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是____________________。
(4)在25℃下,将amol·L—1的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,用含a的代数式表示HCN的电离常数Ka=_________________。若25ºC 时Ka=1×10-9则同体积均为0.1mol·L-1的NaCN、HCN的混合溶液中下列说法不正确的是
a.此溶液一定有C(Na+)+C(H+)=C(OH‾)+C(CN‾)
b.混合溶液中水的电离程度一定大于该温度下纯水的电离程度。
c.此溶液一定有C(Na+)="C(HCN)+" C(CN‾)
d.此溶液加入少量氢氧化钠或盐酸溶液的PH值变化不大
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程是____________。