(17分)运用化学反应原理研究溶液的组成与性质具有重要意义。请回答下列问题:
(1)用惰性电极电解含有NaHCO3的NaCl溶液,假设电解过程中产生的气体全部逸出,测得溶液pH变化如图所示。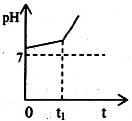
则在0→t1时间内,阳极反应式为 ,溶液pH升高比较缓慢的原因是(用离子方程式回答) 。
(2)含氨废水易引发水体富营养化。向NH4Cl溶液中加入少量NaOH固体,
溶液中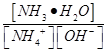 ______________(填“增大”“减小”或“不变);25℃时,NH3·H2O的电离平衡常数Kb=1.8×10—5mol·L—1,该温度下,1 mol·L—1的NH4Cl溶液中c(H+)="________________" mol
______________(填“增大”“减小”或“不变);25℃时,NH3·H2O的电离平衡常数Kb=1.8×10—5mol·L—1,该温度下,1 mol·L—1的NH4Cl溶液中c(H+)="________________" mol L
L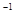 。(已知
。(已知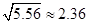 )
)
(3)如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的 。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式 。
(4)某工业生产中,向含有大量Ca2+、Mn2+的溶液中加入足量NH4HCO3,生成MnCO3沉淀和CO2,写出该反应的离子方程式 ,剩余溶液中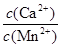 < 。
< 。
[已知Ksp(MnCO3)=1×10-11(mol·L-1)2,Ksp(CaCO3)="5" ×10-9(mol·L-1)2]
(6分)稀硝酸和足量的铁反应的化学方程式如下:
3Fe + 8HNO3 = 3Fe(NO3)2+ 2NO↑+ 4H2O
(1)该氧化还原反应的氧化剂是,氧化产物是。
(2)请用双线桥法表示出电子转移的方向和数目:
3Fe +8HNO3 = 3Fe(NO3)2+2NO↑+4H2O
(3)若生成标准状况下11.2LNO气体,反应中被还原的HNO3的物质的量为________。
(2分)已知石棉是硅酸盐矿物,某种石棉的化学式可表示为Ca2Mg5Si8O22(OH)2,将其改写成氧化物的形式_______________________________。
(6分)在下列物质中:
①烧碱②NH3·H2O③CO2④铁片⑤石墨 ⑥酒精⑦醋酸⑧碳酸钙
(1)属于弱电解质的是_______________;
(2)属于强电解质的是;
(3)既不属于电解质又不属于非电解质的是___________________。
有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A与D按原子个数比1﹕1或2﹕l形成常温下为液态的化合物,E也能与D按原子个数比1﹕1或2﹕l形成化合物,B的外围电子数为内层电子数的两倍,B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。请按要求回答以下问题: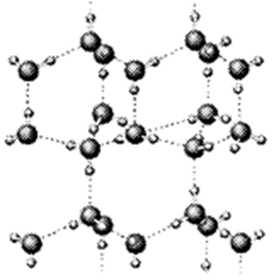
(1)上图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示, E与D按原子个数比1﹕1形成的化合物的电子式为。
(2)人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 |
F—D |
F—F |
B—B |
F—B |
C═D |
D═D |
| 键能/kJ·mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②F单质晶体中一个F原子与其紧邻的F原子形成的空间构型为_____________,
③已知加热下可发生如下转化:
F(s) + D2(g)加热FD2(s)
根据上表数据计算F单质晶体发生上述反应的反应热△H为:。
(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是(填编号)。写出 号元素的核外电子排布式_______________________________________;
号元素的核外电子排布式_______________________________________; 第一电离能的大小关系为________________(用元素符号表示)
第一电离能的大小关系为________________(用元素符号表示)
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为(用对应的元素符号表示)。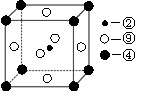
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是。
| A.分子中含有氢键 | B.易发生加成反应 |
| C.含有4个σ键和1个π键 | D.分子中所有原子处于同一个平面 |
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的价电子数为; 该元素与元素①形成的分子X在①与③形成的分子Y中的溶解度很大,其主要原因是。