(9分)如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
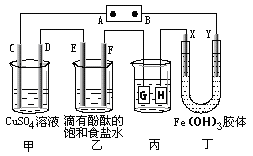
(1)B极是电源的 ,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 ,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为 ,甲中溶液的pH (填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是 。
三硅酸镁被用来治疗胃溃疡是因为该物质不溶于水,服用后中和胃酸作用持久。把三硅酸镁Mg2Si3O8·nH2O改写成氧化物形式为:_________________,写出和胃酸反应的化学方程式:_____________________________________。
A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如下图所示。其中A、B、C、D、E在常温下都是气体,B为红棕色。
(1)写出各下列物质的化学式:则A是D是。
(2)写出下列反应的化学方程式:
B→C的化学方程式为。
E→C的化学方程式为
燃煤锅炉将排放大量SO2,污染大气造成公害,常采用两种方法消除燃煤SO2的污染。
(1)使排放的烟气通过氨水洗涤,化学方程式是
(2)在煤中加适量石灰,使SO2与石灰反应,化学方程式为,
该生成物仍可被氧化而成稳定的石膏,化学方程式为。
在下列用途或反应中,硫酸表现出的性质为:
| A.高沸点; | B.强酸; | C.吸水性; | D.脱水性;E.强氧化性。试用字母填空: |
(1)实验室制取氢气________________;(2)干燥氢气________________;
(3)浓硫酸溶解金属铜________________;(4)浓硫酸可用钢瓶贮运_____;
(5)硫酸使蔗糖变黑_______________;
在NH3、H2、N2、O2、SO2、NO2、Cl2等七种气体中:
(1)比空气密度小的气体是;
(2)有刺激性气味的气体是;
(3)有颜色的气体是;
(4)水溶液呈碱性的气体是;
(5)常用作氧化剂的气体是;
(6)常用作还原剂的气体是;
(7)能用排水法收集的气体是;
(8)能与水反应,且在反应中既做氧化剂又做还原剂的气体是。