(12分)某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。


(1)将上述反应设计成原电池如图甲所示,请回答下列问题:
①图中X溶液的溶质是____(填化学式),Cu电极上发生的电极反应方程式为 。
②原电池工作时,盐桥中的_____________ (填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量关系如图丙,请回答下列问题:
①M是直流电源的__________极;图丙中的②线是_________的物质的量的变化。
②当电子转移为2mol时,向乙烧杯中加入________ L5mol·L-1NaOH溶液,才能使溶液中所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O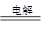 Na2FeO4+3H2↑,则电解时阳极的电极反应方程式为__________________________________。
Na2FeO4+3H2↑,则电解时阳极的电极反应方程式为__________________________________。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为___________________________________。
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO2-4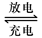 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是______________;电解液中H2SO4的浓度将变________;当外电路通过1mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成__________、B电极上生成________,此时铅蓄电池的正负极的极性将__________________。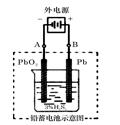
化学电池在通讯、交通及日常生活中有着广泛的应用,目前常用的镍(Ni)镉(Cd)电池,其电池总反应可示为: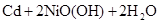

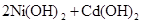
(1)下列有关镍镉电池总反应的说法中,正确的是________(填序号);
①以上反应是可逆反应②以上反应不是可逆反应
③充电时化学能转变为电能④放电时化学能转变为电能
(2)已知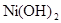 和
和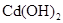 均难溶于水.有资料表明,一节废镍镉电池可以使一平
均难溶于水.有资料表明,一节废镍镉电池可以使一平
方米面积的耕地失去使用价值,在酸性土壤中这种污染尤为严重.这是因为___
_____________________________________;
(3)另一种常用的电池是锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年.电池总反应可表示为: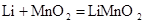 .试回答:①锂电池比容量特别大的原因是_______________________________________;
.试回答:①锂电池比容量特别大的原因是_______________________________________;
②锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因_______________________________________.
化学课上,化学研究小组的同学将一块铜片和一块锌片插入西红柿,做成西红柿电池,该组同学想探究西红柿电池的电压大小与哪些因素有关,小组出现了两种观点:一种认为与两金属之间的距离有关,另一组认为与金属片插入西红柿的深度有关。为了验证猜想是否正确,他们找来电压表,将铜片和锌片的一端对称插入西红柿的果肉内,另一端接上导线与电压表相连构成闭合回路。
(1)请你选择其中一种猜想,并提出验证的方法:
(2)目前人们乱扔电池的现象非常普遍,请你给有关部门提个建议:_________
写出下述变化的化学方程式,并注明反应条件和反应类型
⑴、乙烷跟氯气见光的反应:
⑵、由乙烯制备1,2—二溴乙烷:
⑶、苯与硝酸和浓硫酸的反应:
⑷、用甲苯制TNT的反应:
⑸、用苯制环己烷的反应:
⑹、乙烯燃烧:
常温下,一种烷烃A和一种烯烃B组成混合气体,A、B分子最多只含4个碳原子,且B分子的碳原子数比A分子的多。将1L该混合气体充分燃烧,在同温同压下得到2.5LCO2气体,试推断混合气体中A和B所有可能的组合及其体积比,并将结果填如下表:
| 组合编号 |
A的分子式 |
B的分子式 |
A和B是体积比 (VA:VB) |
| ① |
|||
| ② |
|||
| ③ |
|||
| ④ |