氯原子对O3的分解有催化作用:
O3+Cl==ClO+O2 ΔH1,ClO+O ="=" Cl+O2 ΔH2。大气臭氧层的分解反应是:O3+O ="==" 2O2 ΔH,该反应的能量变化如图所示,则下列叙述正确的是
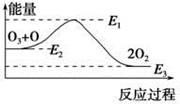
| A.反应O3+O ="==" 2O2的ΔH = E1-E3 |
| B.反应O3+O ="==" 2O2是吸热反应 |
| C.ΔH = ΔH1+ΔH2 |
| D.氯原子没有改变O3分解反应的历程 |
下列表示物质结构的化学用语或模型图正确的是
A.H2O2的电子式: |
B.CH4的球棍模型: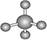 |
C.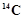 的原子结构示意图: 的原子结构示意图: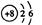 |
D.CCl4的结构式: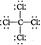 |
我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指
| A.氨水 | B.硝酸 | C.醋 | D.卤水 |
2014年5月7日南京某建设公司丢失用于材料探伤的放射源Ir—192(铱—192)一枚,经相关部门的努力追查,丢失的放射源于5月10日被回收,Ir—192的放射性会对人体产生很大的伤害。已知Ir元素位于周期表中第6周期第Ⅷ族,原子序数为77,192为该核素的质量数,下列关于Ir—192的说法正确的是
| A.Ir—192核外含有115个电子 |
| B.Ir为非金属元素 |
| C.Ir—192中子数与质子数的差为38 |
| D.Ir元素与碘元素位于同一周期 |
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为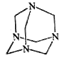
| A.1∶1 | B.2∶3 | C.3∶2 | D.2∶1 |
在元素周期表中,从ⅢA族的硼到ⅦA族的砹作一条斜线,即为金属与非金属的分界线,依据规律应在这一条分界线附近寻找的是
| A.新型催化材料 | B.半导体材料 |
| C.新型耐高温材料 | D.耐腐蚀的合金材料 |