按要求填空。
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是__ ______。
(2)已知拆开1 mol H—H键、1 mol I—I分别需要吸收的能量为436 kJ、151 kJ,而形成1 mol H—I键会释放299 kJ能量。则由氢气和碘反应生成1 mol HI需要________(填“放出”或“吸收”)_______ __kJ的热量。
(3)S(g)+O2(g)=SO2(g) ΔH 1<0;S(s)+O2(g)=SO2(g) ΔH 2<0,比较ΔH1 __ ___ΔH2大小。
下列各组物质:① O2和O3;②12C和14C;③ CH3CH2CH2CH3和(CH3)2CHCH3;④乙烷和丁烷;⑤ CH3CH2CH2CH(C2H5)CH3和 CH3CH2CH2CH(CH3)C2H5。
互为同系物的是,互为同分异构体的是,互为同位素的是,互为同素异形体的是,是同一物质的是。
某芳香烃A有如下转化关系: 
⑴ 写出反应②和⑤的反应条件:②;⑤.
⑵ 写出A和F结构简式:A;F.
⑶ 写出反应③对应的化学方程式:.
⑷ 属于取代反应的有(填序号).
⑸ 根据已学知识和获取的信息,以CH3COOH , 为原料合成重要的化工产品
为原料合成重要的化工产品 ,写出相应的合成路线流程图(无机试剂任用)
,写出相应的合成路线流程图(无机试剂任用)
请参考如下形式:

A、B、C、D、E、F、G、H、I、J均为有机化合物,根据以下框图,回答问题:
(1)B和C均为有支链的有机化合物,B的结构简式为__________;C在浓硫酸作用下加热反应只能生成一种烯烃D,D的结构简式为__________________。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为________。
(3)写出⑤的化学反应方程式____________________________________________。⑧的化学反应方程式____________________________________________。
(4)①的反应类型________,④的反应类型________,⑦的反应类型________。
(5)与H具有相同官能团的H的所有同分异构体的结构简式为___________________。
金刚烷是一种重要的化工原料,工业上可通过下列途径制备: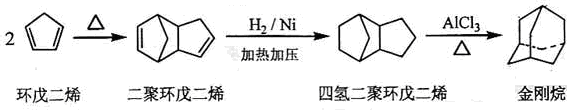
请回答下列问题:
(1)金刚烷的分子式为,其分子中的CH2基团有个;
(2)下面是以环戊烷为原料制备环戊二烯的合成路线: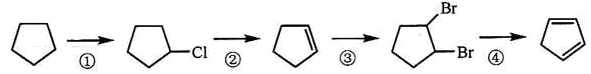
其中,反应①的反应试剂是,反应③的方程式,反应④的反应类型是;
(3)已知烯烃能发生如下的反应: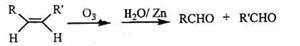
请写出下列反应产物的结构简式: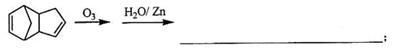
下列3种有机化合物A: CH2=CH-CH3 B: C:CH3CH2OH
C:CH3CH2OH
(1)写出化合物A、C中的官能团的名称、。
(2)A在催化剂加热条件下聚合生成聚合物的反应方程式为,反应类型为。
(3)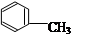 在浓硫酸作用下,与浓硝酸共热至100℃反应的化学方程式为:。
在浓硫酸作用下,与浓硝酸共热至100℃反应的化学方程式为:。
(4)B可以被酸性高锰酸钾氧化成苯甲酸,写出苯甲酸与C物质与浓硫酸共热发生酯化反应的化学方程式:。