(1)室温下,以惰性电极电解100 mL 0.1mol/LNaCl溶液,写出电解总反应的化学方程式 ;若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为________(忽略反应前后溶液的体积变化)。
(2)25℃时,在浓度均为1mol/L的三种溶液:a (NH4)2SO4、b (NH4)2CO3、c (NH4)2Fe(SO4)2中,c(NH4+)由大到小的顺序是 (用a、b、c表示)
(3)已知反应2HI(g) = H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为______________kJ。
【化学—物质结构与性质】
下表为长式周期表的一部分,其中的编号代表对应的元素。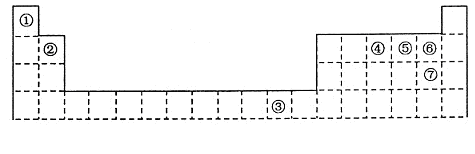
(1)元素③基态原子的价电子排布式为。
(2)②与⑦形成的化合物的空间构型为。
(3)元素④⑤⑥的第一电离能由大到小的顺序是(填元素符号)
(4)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因。
(5)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构如图所示。下列说法正确的是。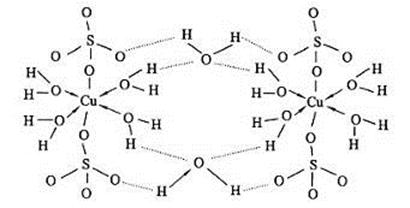
a.在上述结构示意图中,所有氧原子都采用sp3杂化
b.胆矾CuSO4·5H2O中,存在配位键、共价键和离子键
c.胆矾是分子晶体,分子间存在氢键
d.胆矾中的水在不同温度下会分步失去
(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:在NF3分子中,。(已知电负性:F>N>H)
高锰酸钾是一种典型的强氧化剂。完成下列填空:
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO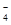 +Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO +CuS +H+→Cu2++SO2↑+Mn2++H2O(未配平)
+CuS +H+→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
(2)标出反应②配平后2种反应物前面的系数:MnO +CuS+…..
+CuS+…..
II:在稀硫酸中,MnO 和H2O2也能发生氧化还原反应
和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO +8H++5e-===Mn2++4H2O
+8H++5e-===Mn2++4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为。
(4)已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是mol。
III:实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。
请回答:
(5)用软锰矿制备K2MnO4的化学方程式是:。
(6)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为。KMnO4、K2MnO4和MnO2的氧化性由强到弱的顺序是。(用“>”“<”或“=”表示)。
I:某无色废水中可能含有H+、NH、Fe3+、Al3+、Mg2+、Na+、NO、CO、SO中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关图像如下所示:
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的离子有:。
(2)写出实验③图像中沉淀溶解阶段发生的离子反应方程式:。
(3)分析图像,在原溶液中c(NH )与c(Al3+)的比值为。NO
)与c(Al3+)的比值为。NO 是否存在?填(“存在”“不存在”或“不确定”)。
是否存在?填(“存在”“不存在”或“不确定”)。
II:现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 |
OH-、C1-、CO32-、NO3-、SO4- |
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物。
试回答下列问题:
(1)A溶液呈碱性的原因是(用一个离子方程式表示)。
(2)D溶液是溶液,E溶液是溶液(均写化学式)。
(3)写出A溶液与E溶液反应的离子方程式:。
FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I:实验需要90mL 0.1mol/LFeBr2溶液
(1)配制FeBr2溶液除烧杯、玻璃棒、量筒、胶头滴管外还需的玻璃仪器是
(2)下列有关配制过程中说法正确的是(填序号)。
a.用托盘天平称量质量为1.94g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏低
II:探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br- 被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+ 被Cl2氧化成Fe3+。
请你完成下表,验证假设:
| 实验步骤、预期现象 |
结论 |
| ①向溶液中加入适量CCl4,振荡、静置后 现象:__________________________; |
假设1正确 |
| ②向溶液中加入溶液 现象:。 |
假设2正确 |
若假设1正确,从实验①中分离出Br2的实验主要操作名称是;
(2)实验证明:还原性Fe2+ > Br-
请用一个离子方程式来证明:;
(3)若在50mL上述FeBr2溶液中通入5×10-3molCl2,则反应的离子方程式为:。
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下:试回答下列问题: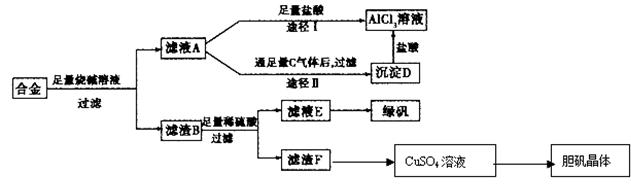
(1)器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是(填名称)。
(2)由滤液A制得AlCl3溶液有途径I和Ⅱ两条,你认为合理的是____________。写出A经途径Ⅱ生成D的离子方程式。
(3)从滤液E中硫酸得到绿矾晶体的实验操作是。
(4)写出用滤渣F制备CuSO4溶液的化学方程式(要求节约,环保)。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理,理由是