【化学—物质结构与性质】
下表为长式周期表的一部分,其中的编号代表对应的元素。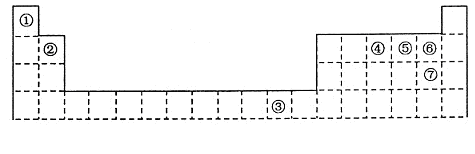
(1)元素③基态原子的价电子排布式为 。
(2)②与⑦形成的化合物的空间构型为 。
(3)元素④⑤⑥的第一电离能由大到小的顺序是 (填元素符号)
(4)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因 。
(5)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构如图所示。下列说法正确的是 。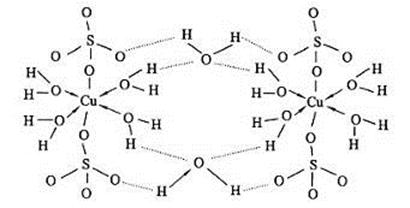
a.在上述结构示意图中,所有氧原子都采用sp3杂化
b.胆矾CuSO4·5H2O中,存在配位键、共价键和离子键
c.胆矾是分子晶体,分子间存在氢键
d.胆矾中的水在不同温度下会分步失去
(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:在NF3分子中, 。(已知电负性:F>N>H)
依据氧化还原反应: 2Ag+(aq) + Cu(s) ="==" Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:
2Ag+(aq) + Cu(s) ="==" Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题: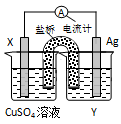
(1)电极X的材料是;电解质溶液Y是。
(2)外电路中的电子是从电极流向电极。
(3)银电极上发生的电极反应式为
25℃时,50mL 0.10mol/L的醋酸中存在着如下平衡:
CH3COOH  CH3COO―+H+
CH3COO―+H+
加入少量冰醋酸,平衡将______(填“向右移动”、“向左移动”或“不移动”),溶液中C(H+)将_______(填“增大”、“减小”或“不变”),醋酸的电离程度将__________(填“增大”、“减小”或“不变”)。
(9分)已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z ,且存在如下转化关系,试推断回答下列问题。
,且存在如下转化关系,试推断回答下列问题。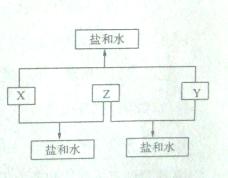
(1)D元素原子的结构示意图为 ;
(2)A、B、C三种元素的原子半径由小到大的顺序为(用元素符号表示);
(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为
;
(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈_________(填“酸”、“碱”或“中”)性;
(5)实验室中,应将X的浓溶液保存在棕色试剂瓶中,其原因是
(用化学方程式表示)。
(10分)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是 ,向其中加入少量KOH溶液时,发 生反应的离子方程式是 ;
生反应的离子方程式是 ;
(2)现将0.04 mol·L-1HA溶液和0.02 mol·L-1NaOH溶液等体积混合,得到缓冲溶液。
①若HA为HCN ,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”),你得出该结论的依据是
,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”),你得出该结论的依据是
②若HA为CH3COOH,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是 。
(14分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡表达式为:K=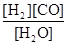 ,它所对应的化学反应为:
,它所对应的化学反应为:
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+C02(g) 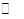 2C0(g),K1 ①
2C0(g),K1 ①
CO(g)+H20(g) 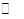 H2(g)+C02(g),K2 ②
H2(g)+C02(g),K2 ②
C(s)+H20(g)  CO(g)+H2(g),K3 ③
CO(g)+H2(g),K3 ③
则 K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
简述理由:
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如N0、N02、N204等。对反应N2O4(g)  2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )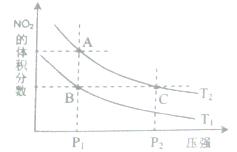
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
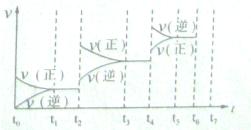
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N204、N02的量),反应速率v与时间t关系如图所示。图中t4时引起平衡移动的条件可能是;图中表示平衡混合物中N02的含量最高的一段时间是。