下列有关工业生产的叙述不正确的是
| A.用海水淡化后的浓缩海水作原料提取溴 |
| B.在太阳能资源相对充足的沿海地区建造海水淡化厂 |
| C.利用“海水→氯化钠→金属钠→氢氧化钠”的工艺流程生产烧碱 |
| D.利用“海水→氢氧化镁→氯化镁→金属镁”的工艺流程生产金属镁 |
25℃时,下列各组离子在指定溶液中一定能大量共存的是
| A.pH=14的溶液中:K+、NH4+、NO3-、HCO3- |
| B.能使甲基橙变红的溶液中:Na+、K+、SO42-、AlO2- |
| C.0.1mol·L-1Fe(NO3)2溶液中:H+、Ca2+、SCN-、Cl- |
| D.0.1mol·L-1AlCl3溶液中:Cu2+、Mg2+、SO42-、NO3- |
下列有关化学用语表示正确的是
A.中子数为20的氯原子: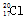 |
| B.苯的结构简式:C6H6 |
C.硅的原子结构示意图: |
D.Na2S的电子式: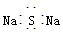 |
2014年诺贝尔化学奖授予超高分辨率荧光显微镜的贡献者。人类借助于这种显微镜可以观察到单个的蛋白质分子。下列有关叙述不正确是
| A.蛋白质中含有碳、氢、氧、氮等元素 |
| B.蛋白质属于高分子化合物 |
| C.蛋白质可完全水解生成氨基酸 |
| D.消毒过程中细菌蛋白质发生了盐析 |
某种溶液只含下表离子中的几种(不考虑水的电离与离子水解),且各种离子的物质的量浓度均为0.1 mol·L-1。
| 阳离子 |
K+ NH4+Fe2+Mg2+ Al3+Cu2+ |
| 阴离子 |
OH- Cl- AlO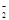 CO CO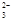 SO SO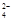 SiO SiO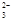 |
某同学进行了如下实验(必要时可加热):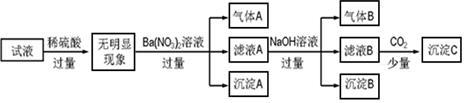
下列说法正确的是
A.原溶液中只含有NH4+、Fe2+、Cl-、SO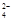
B.由沉淀A推断原溶液中一定含有SO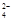
C.滤液A中可能含有K+、Al3+、Cl-
D.沉淀B中一定含有Mg(OH)2
已知部分弱酸的电离平衡常数如下表:
| 弱酸 |
醋酸 |
次氯酸 |
碳酸 |
亚硫酸 |
| 电离平衡常数(25℃) |
Ka=1.75×10-5 |
Ka=2.98×10-8 |
Ka1=4.30×10-7 Ka2=5.61×10-11 |
Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO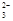 +2HClO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO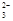 =SO
=SO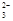 +2HCO3-
+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O