关于下列各实验或装置的叙述中,正确的是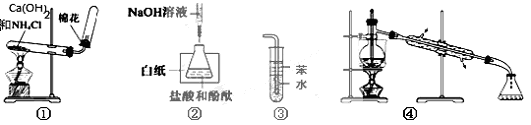
| A.实验①可用于制取并收集氨气 |
| B.实验②中滴入最后一滴NaOH标准液使锥形瓶内溶液由无色变为浅红色,即达到滴定终点 |
| C.装置③可用于吸收尾气中少量NH3或HCl,并防止倒吸 |
| D.装置④可用于从酒精水溶液中制取无水乙醇 |
下列化学用语的表示正确的是()
| A.乙酸的分子式:C2H4O2 | B.乙醇的结构简式:C2H6O |
C.氟原子结构示意图: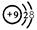 |
D.四氯化碳的电子式: |
实验中的下列操作正确的是
| A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,把过量的试剂倒入试剂瓶中 |
| B.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
| C.用蒸发方法使NaCl从溶液中析出,应将蒸发皿中NaCl溶液全部蒸干才停止加热 |
| D.分液操作时,分液漏斗中下层液体从下口放出,上层液体也从下口放出 |
将少量下列物质分别加入足量的水中,充分搅拌后能形成溶液的是()
| A.粉笔灰 | B.冰块 | C.食盐 | D.色拉油 |
F和F—两种粒子中,不相同的是()
①核内质子数②核外电子数③最外层电子数④核外电子层数
| A.①② | B.②③ | C.③④ | D.②③④ |
从化学试剂商店买来的氢氧化钠试剂瓶上所贴的危险化学品标志是