用试纸检验气体性质是一种重要的实验方法。如下表所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是
| 选项 |
物质 |
试纸名称 |
现象 |
性质 |
| A |
Na2SO3、硫酸 |
品红试纸 |
褪色 |
SO2具有漂白性 |
| B |
浓氨水、生石灰 |
蓝色石蕊溶液 |
变红 |
氨气为碱性气体 |
| C |
碘水 |
淀粉试纸 |
变蓝 |
碘具有氧化性 |
| D |
Cu、浓硝酸 |
KI淀粉试纸 |
变蓝 |
NO2为酸性气体 |
向体积为Va的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系正确的是
| A.Va= Vb时:c(CH3COO-)= c(K+) |
| B.Va<Vb时:c(CH3COOH)+ c(H+)= c(OH-) |
| C.Va>Vb时:c(CH3COO-) > c(K+) > c(OH-) > c(H+) |
| D.Va与Vb任意比时:c(K+) + c(H+)= c(OH-) + c(CH3COO-) |
下列关于化学反应的自发性叙述中正确的是
| A.焓变小于0而熵变大于0的反应肯定是自发的 |
| B.焓变和熵变都小于0的反应肯定是自发的 |
| C.焓变和熵变都大于0的反应肯定是自发的 |
| D.熵变小于0而焓变大于0的反应肯定是自发的 |
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量)。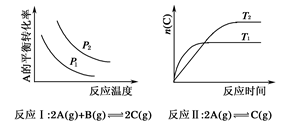
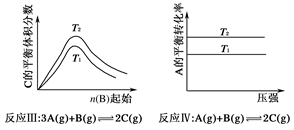
根据以上规律判断,下列结论正确的是
| A.反应Ⅰ:ΔH>0,p2>p1 |
| B.反应Ⅱ:ΔH<0,T1<T2 |
| C.反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2<T1 |
| D.反应Ⅳ:ΔH<0,T2>T1 |
反应N2O4(g)  2NO2(g) 的正反应为吸热反应,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g) 的正反应为吸热反应,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
A.A、C两点的反应速率:A > C
B.由状态B到状态A,可以用加热的方法
C.A、C两点混合气体的平均相对分子质量:A > C
D.B、C两点的反应速率相等
COCl2(g) CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
| A.①②④ | B.①④⑥ | C.②③⑤ | D.③⑤⑥ |