一定温度下,在一个容积为1 L的密闭容器中,充入1 mol H2(g)和1 mol I2(g),发生反应H2(g)+I2(g) 2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,在该温度下,在另一个容积为2 L的密闭容器中充入1 molHI(g)发生反应HI(g)
2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,在该温度下,在另一个容积为2 L的密闭容器中充入1 molHI(g)发生反应HI(g) 1/2 H2(g)+ 1/2 I2(g),则下列判断正确的是
1/2 H2(g)+ 1/2 I2(g),则下列判断正确的是
| A.后一反应的平衡常数为1 |
| B.后一反应的平衡常数为0.5 |
| C.后一反应达到平衡时,H2的平衡浓度为0.25 mol·L-1 |
| D.后一反应达到平衡时,HI(g)的平衡浓度为0.5 mol·L-1 |
对于下列反应的反应类型的判断,不正确的是()
| A.CO2+H2O====H2CO3化合反应 |
B.Cu(OH)2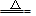 CuO+H2O 分解反应 CuO+H2O 分解反应 |
C.Fe2O3+3CO 2Fe+3CO2置换反应 2Fe+3CO2置换反应 |
| D.NaCl+AgNO3====AgCl↓+NaNO3复分解反应 |
下列物质属于纯净物的是()
| A.冰水混合物 | B.爆鸣气 |
| C.天然气 | D.纯净的无污染的空气 |
在298 K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol·L-1 NaOH溶液中充分反应,测得反应放出x kJ的热量。已知该条件下,1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是 ( )
| A.CO2(g)+NaOH(aq)===NaHCO3(aq)ΔH=-(2y-x)kJ·mol-1 |
| B.CO2(g)+NaOH(aq)===NaHCO3(aq)ΔH=(4x-y)kJ·mol-1 |
| C.CO2(g)+NaOH(aq)===NaHCO3(aq)ΔH=-(4x-y)kJ·mol-1 |
| D.2CO2(g)+2NaOH(aq)===2NaHCO3(aq)ΔH=-(8x+2y)kJ·mol-1 |
对于重水(D2O)(常温下D2O的离子积是1.6×10-15),可以用和pH值一样的定义来规定重氢离子的负对数pD,下列关于pD值的叙述正确的是()
| A.中性重水的pD值为7 |
| B.在1L重水中溶解0.01molDCl,其pD值为4 |
| C.在1L重水中溶解0.01molNaOD,其pD值为12 |
| D.在100mL0.25mol/L的DCl重水溶液中加入50mL0.2mol/L的NaOD的重水溶液时,其pD值为1 |
在体积均为1.0L的恒容密闭容器中加入足量的相同的炭粉,再 分别加入0.1molCO2和
0.2molCO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是()
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是()
| A.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) |
B.反应CO2(g)+C(s) 2CO(g)的△S>0、△H<0 2CO(g)的△S>0、△H<0 |
| C.体系的总压强P总:P总(状态Ⅱ)<2P总(状态Ⅰ) |
| D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |