在0.4 L由NaCl 、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。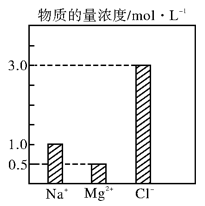
(1)该混合液中,NaCl的物质的量为____________mol,含溶质MgCl2的质量为______________g。
(2)该混合液中CaCl2的物质的量为____________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为______________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀____________mol。
有A、B、C、D、E、F六种短周期元素,原子序数依次增大,且分属于四个主族。已知A的一种核素的原子核只有质子,B原子的最外层电子数是次外层电子数的2倍。B原子的最外层电子数是D、E原子最外层电子数之和,C原子的最外层电子数是D、F原子最外层电子数之和。请回答下列问题:
(1) 写出由A、B两种元素组成的具有10个电子的分子的电子式
(2) 用电子式表示A与D形成化合物的过程;
(3) A、B、C、D、E、F原子半径由大到小的顺序为,
(4) B、C、F氢化物稳定性由强到弱的顺序为(用化学式表示),
(5) 写出一个化学方程式证明B和C的非金属性强弱。
下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① |
|||||||||||||||||
| ② |
③ |
④ |
⑤ |
⑥ |
|||||||||||||
| ⑦ |
⑧ |
||||||||||||||||
| ⑨ |
⑩ |
(1)写出上表中元素⑨原子的外围电子排布式。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为:
(3)按要求完成下列各题
a.第一电离能:元素④元素⑤(选填“>”、“=”、“<”)。
b.与元素④所形成的单质互为等电子体的分子、离子的化学式、(各写一种)。
c.元素④的气态氢化物X的水溶液在微电子工业中,可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________________________
d.由X与氧气、KOH溶液构成原电池,负极会产生元素④的单质。则其负极反应式为_____________________________。
(4)由元素③和⑧形成的液态化合物Z,是非极性的直线形分子。0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。该反应的热化学方程式为_________________________
(5)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:。
(6)元素⑩所形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。已知该原子的半径为d,相对原子质量为M,NA代表阿伏加德罗常数,请回答:
晶体中该原子的配位数为,一个晶胞中包含的原子数目为;该晶体的密度为(用字母表示)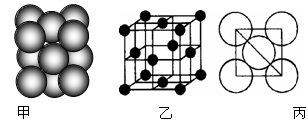
下表列出了前三周期部分元素在周期表中的位置。请根据表中信息回答下列问题:
(1)②的元素符号为
(2)③、④、⑤中原子半径最大的是(填元素符号)。
(3)Mg与⑤两种元素形成的化合物为化合物(填“离子”或“共价”)。
(4)上表中非金属性最强的是(填元素名称)请用元素周期律的知识说明原因
(5)②③④⑤这四种元素的气态氢化物中稳定性最小的是最高价氧化物对应水化物中酸性最强的是(填分子式)
现将 四种溶液分别盛于A、B、C、D四支试管中,进行如下实验:① A、B混合产生蓝色沉淀;②将A、D混合产生白色沉淀;
四种溶液分别盛于A、B、C、D四支试管中,进行如下实验:① A、B混合产生蓝色沉淀;②将A、D混合产生白色沉淀;
③将C、D混合产生黄色沉淀。
根据以上现象判断:
(1)写出有关化学式:A_________;B___________; C_________;D_________。
(2)写出下列各反应的化学方程式:
A+B_______________________________
A+D_______________________________
C+D_______________________________
乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式___________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
A.稀硫酸 B.溴的四氯化碳溶液 C.水 D.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2C.CH3CH2OH D.CH3CH2Br