在具有活塞的密闭容器中,一定温度下的可逆反应,H2(g)+I2(g)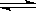 2HI(g)已达平衡,将活塞外拉,在此过程中:
2HI(g)已达平衡,将活塞外拉,在此过程中:
(1)容器颜色 (填“变浅”或“变深”)
(2)容器内的压强 (填“变大”“变小”或“不变”)
(3)混合气体的密度 (填“变大”“变小”或“不变”
焊接铜器时,可用NH4Cl先除去表面的氧化铜再进行焊接,该反应可表示为
4CuO+2NH4Cl3Cu +CuCl2 +N2↑+ 4H2O
(1)该反应的氧化剂是_______________,氧化产物是____________;
(2)该反应中,_________元素未被氧化;
(3)氧化剂和还原剂的质量比是_______________(最简整数比);
(4)反应中转移电子的总数为____________________。
根据反应8NH3 +3Cl2=6NH4Cl +N2 ,回答下列问题:
(1)氧化剂是__________,还原剂是______________。
(2)氧化剂与还原剂的分子个数比为_____________。
(3)当有68gNH3参加反应时,被氧化的物质为____________g,生成的还原产物为____________g。
酒后驾车的司机,可通过对其呼出的气体进行检验而查出,所利用的化学反应如下:
2CrO3 (红色) +3C2H5OH +3H2SO4= Cr2(SO4)3(绿色) +3CH3CHO +6H2O
被检测的气体成份是__________,上述反应的氧化剂是____________,还原剂是______。
写出符合下列要求的化学方程式
(1)一种单质还原一种化合物:_________________________;
(2)盐酸在反应中既不是氧化剂也不是还原剂:__________________________;
(3)水在反应中既是氧化剂又是还原剂:________________________;
(4)一种单质氧化一种化合物:_________________________。
(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式 ____________________________
(2)在上述溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式_____________________________