有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的Na+的物质的量浓度(单位:mol·L-1)为
| A.(y-2x)/a | B.(y-x)/a | C.(2y-4x)/a | D.(2y-2x)/a |
下列文字表述与反应方程式对应且正确的是( )
| A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+===AgBr↓ |
| B.用醋酸除去水垢:CaCO3+2H+===Ca2++H2O+CO2↑ |
| C.利用腐蚀法制作印刷线路板:Fe3++Cu===Fe2++Cu2+ |
D.实验室用液溴和苯在催化剂作用下制溴苯:+Br2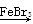 Br+HBr Br+HBr |
有甲酸、乙酸、乙醛、乙酸乙酯、乙醇、溴乙烷6种无色溶液,只用一种试剂就可以将它们一一鉴别出来。这种试剂是( )
| A.蒸馏水 | B.FeCl3溶液 |
| C.Cu(OH)2悬浊液 | D.NaOH溶液 |
只用水就能鉴别的一组物质是( )
| A.苯、乙酸、四氯化碳 | B.乙醇、乙醛、乙酸 |
| C.乙醛、乙二醇、硝基苯 | D.苯酚、乙醇、甘油 |
下列各组物质中不易用物理性质区别开的是( )
| A.苯和四氯化碳 | B.酒精和汽油 |
| C.氯化铵和硫酸铵晶体 | D.碘和高锰酸钾固体 |
甲烷是最简单的烷烃,乙烯是最简单的烯烃,下列物质中,不能用来鉴别二者的是( )
| A.水 | B.溴水 |
| C.溴的四氯化碳溶液 | D.酸性高锰酸钾溶液 |