下列文字表述与反应方程式对应且正确的是( )
| A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+===AgBr↓ |
| B.用醋酸除去水垢:CaCO3+2H+===Ca2++H2O+CO2↑ |
| C.利用腐蚀法制作印刷线路板:Fe3++Cu===Fe2++Cu2+ |
D.实验室用液溴和苯在催化剂作用下制溴苯:+Br2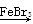 Br+HBr Br+HBr |
某无色溶液中可能含有Na+、K+、Fe3+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br- 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
① pH试纸检验,溶液的pH > 7。
② 取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。
③ 另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液。
④ 向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤。
⑤ 在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。
则关于原溶液的判断中不正确的是()
| A.肯定不存在的离子是Fe3+、Cu2+、SO42-、CO32- |
| B.肯定存在的离子是Na+、K+、SO32-、Br- 、Cl- |
| C.无法确定原溶液中是否存在Cl- |
| D.若步骤 ④ 改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响。 |
向2mL 、0.5mol/L的FeCl3溶液中加入3mL 、3mol/L KF溶液,结果FeCl3溶液褪成无色,向褪色后的溶液中继续加入KI溶液和CCl4振荡后静置,CCl4层不显色,则下列说法正确的是()
| A.Fe3+ 不与I-发生反应 |
| B.Fe3+ 与F- 结合成不与I- 反应的物质 |
| C.F- 使I- 的还原性减弱,因而不反应 |
| D.Fe3+ 被F- 还原为Fe2+,使溶液中不再存在Fe3+ |
某学生用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(每次加入的盐酸的物质的量浓度相等),下列分析不正确的是()
| 盐酸 /mL |
50 |
50 |
50 |
| m(混合物)/g |
9.2 |
15.7 |
27.6 |
| V(CO2)(标况)/L |
2.24 |
3.36L |
3.36L |
A.盐酸的物质的量浓度为3.0mol/L
B.根据表中数据能计算混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应
将3.64g Fe2O3和Al2O3样品溶解在过量的200mL、pH=1的盐酸溶液中,然后向其中加入适量的NaOH溶液使Fe3+、Al3+ 刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为()
| A.0.1mol/L | B.0.2mol/L | C.0.4mol/L | D.0.8mol/L |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是()
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |