分,除标注每空分外,其余每空掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

(1)写出下列仪器的名称:
a. b. c.
(2)仪器a~e中,使用前必须检查是否漏水的有 。(填序号)
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 。将仪器补充完整后进行实验,温度计水银球的位置在____ __处.冷凝水由____________(填f或g)口通入,___ ___口流出。
(4)现需配制0.1mol·L-1NaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。(写一条)
除了图中给出的仪器和托盘天平外,为完成实验还需要的玻璃仪器有:_____ 、_
②根据计算得知,所需NaOH的质量为______________g。
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
④配制0.1 mol· L-1NaOH溶液的实验中,如果出现以下操作:
A.称量时用了生锈的砝码
B.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
C.往容量瓶转移时,有少量液体溅出
D.未洗涤溶解NaOH的烧杯
E.定容时仰视刻度线
F.容量瓶未干燥即用来配制溶液
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
上述操作中所配溶液的物质的量浓度偏大的有(填写字母)_______________
某学生设 计了如下实验:
计了如下实验:
(1)该同学的实验目的是_____________________________;
(2)上图③操作步骤为________________,④加入试剂为;
(3)按此实验方案得到的NaCl固体中肯定含有__________(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的______________;
(4)写出生成C的化学方程式____________________________。
某无色溶液可能由KNO3、NH4Cl、Na2CO3、CaCl2中的一种或 几种混合而成。往溶液中加入烧碱溶液并微热,则放出能使湿润的红色石蕊试纸
几种混合而成。往溶液中加入烧碱溶液并微热,则放出能使湿润的红色石蕊试纸 变蓝的气体;另取原溶液加入稀H2SO4有气体放出。据此分析该溶液中一定有、;可能有;一定没有;若要确定可能有的物质可通过确定(填操作名称)。
变蓝的气体;另取原溶液加入稀H2SO4有气体放出。据此分析该溶液中一定有、;可能有;一定没有;若要确定可能有的物质可通过确定(填操作名称)。
实验室制配0.5 mol/L的NaOH溶液500 mL,完成下列实验并回答问题。(每空2分)
⑴配制时,一般可分为以下几个步骤,请填空:
①计算:计算实验需要的NaOH固体质量为g;
②称量:用小烧杯和托盘天平迅速准确称量所需的NaOH固体
③溶解:往装有NaOH的小烧杯中加入适量的水溶解,冷却至室温
④转移:将上述冷却后的溶液转入500mL的容量瓶
⑤洗涤:用蒸馏水洗涤小烧杯和玻璃棒2-3次,将洗涤液一并注入容量瓶,轻轻摇动使混合均匀
⑥定容:在容量瓶中继续加水至距刻度线1-2cm处,改用(仪器名称)滴加至凹液面与刻度线相切
⑦摇匀:把定容好的容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动几次,混合均匀
⑵容量瓶在使用前,必须进行的操作是:。
⑶实验两次用到玻璃棒,其作用分别是: 、 。
⑷试分析下列操作对所配溶液的浓度有何影响。(填“偏高”、“偏低”或“无影响” )
①定容摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,对所配溶液浓度的影响___。
②某同学定容时俯视刻度线,则所配制的溶液的浓度_________。
③NaOH溶解后未冷却立即转移到容量瓶中并洗涤定容,则所配制的溶液浓度。
利用过滤的方法可以初步除去粗盐中的泥沙等不溶性的杂质,但仍含有CaCl2,CaCl2是一种易溶于水的物质,无法用过滤的方式将其和NaCl分离,经过分析讨论,某小组同学在此基础上继续设计了如下实验:
回答下列问题:
(1)该小组同学的实验目的是;
(2)上图括号内的操作步骤 为①②;
为①②;
(3)按此实验方案得到的NaCl固体中肯定含有(填化学式)杂质,为了解决这个问题可以向过滤得到的滤液中加入适量的(填名称)。
(4)写出上述实验中加入过量Na2CO3后发生反应的化学方程式。
氮化铝是一种新型的无机非金属材料,被广泛应用于集成电路生产领域。在氮气流中由氧化铝与焦炭在电炉中加热制得。原料配比不当或反应不完全等因素都会造成产品中含有碳、Al4C3或Al2O3等杂质。回答下列问题:
(1)反应Al2O3+N2+ 3C  2AlN+3CO中,氧化剂是。
2AlN+3CO中,氧化剂是。
(2)AlN也可以与强碱溶液反应。完成下列方程式:
AlN+NaOH+H2O=+
(3)Al 4C3与水反应生成甲烷,反应方程式是
甲烷与CuO反应的化学方程式如下:
CH4+4CuO  CO2+2H2O+4Cu
CO2+2H2O+4Cu
为测定产品中有关成分的含量,所需仪器如下: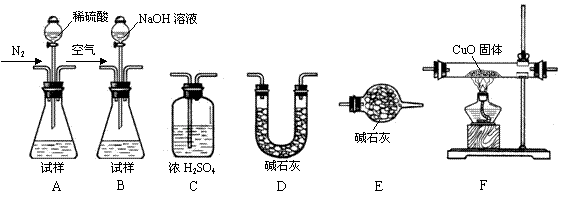 Ⅰ.测定样品中含有少量Al4C3的含量,各装置连接
Ⅰ.测定样品中含有少量Al4C3的含量,各装置连接 的顺序为A→C→F→C→D→E。主要实验步骤
的顺序为A→C→F→C→D→E。主要实验步骤 如下:
如下:
①称量D的质量,按顺序组装仪器,将试样放入锥形瓶中,检查装置的气密性
②从分液漏斗缓缓滴入稀硫酸,直到不再产生气体时为止
③点燃F酒精灯
④缓缓鼓入一定量的N2
⑤再次缓缓鼓入一定量的N2
⑥再次称量D的质量
⑦重复步骤⑤和⑥的操作,直到D的质量基本不变
操作的先后顺序是①→→⑤→⑥→⑦,操作④的目的是 。
。
Ⅱ.为测定AlN的含量,请选择合适的药品和装置,按气流方向连接各装置,其顺序为:
→→→E
若试样为mg,测得C增重n g,则AlN的质量分数是。