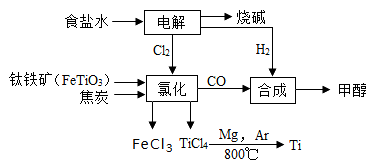
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
请回答下列问题:
(1)Fe位于元素周期表中第________________周期,第_______________族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| |
TiCl4 |
Mg |
MgCl2 |
Ti |
| 熔点/℃ |
-25.0 |
648.8 |
714 |
1667 |
| 沸点/℃ |
136.4 |
1090 |
1412 |
3287 |
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍镉(Ni Cd)电池,其电池总反应可以表示为:
Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是( )
①以上反应是可逆反应
②以上反应不是可逆反应
③充电时化学能转变为电能
④放电时化学能转变为电能
| A.①③ | B.②④ | C.①④ | D.②③ |
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为 。
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正极、负极,并写出电极反应。
正极反应 ;
负极反应 。
某兴趣小组为了提高电池的效率,设计了下图所示的原电池。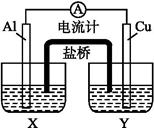
请回答下列问题:
(1)若X是AlCl3溶液,Y是稀硫酸,请你写出电极名称及电极反应:
Al片( ) ____________________________,
Cu片( ) ____________________________。
(2)若X是浓硝酸,Y是NaCl溶液,请你写出电极名称及电极反应:
Al片( ) ____________________________,
Cu片( ) ____________________________。
(1)事实证明,原电池中发生的反应通常是放热反应。利用下列化学反应可以设计成原电池的是 。
A.C(s)+H2O(g) CO(g)+H2(g) ΔH>0
CO(g)+H2(g) ΔH>0
B.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH<0
NaCl(aq)+H2O(l) ΔH<0
C.2H2(g) +O2(g) 2H2O(l) ΔH<0
2H2O(l) ΔH<0
D.CaCO3(s)+2HCl(aq) CaCl2(aq)+H2O(l)+CO2(g) ΔH<0
CaCl2(aq)+H2O(l)+CO2(g) ΔH<0
E.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH<0
CO2(g)+2H2O(l) ΔH<0
(2)有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等物质的量浓度的盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出。据此判断A、B、C、D的活动性由强到弱的顺序是 。
已知氨水与醋酸的电离程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+H2O NH3·H2O+H+②
NH3·H2O+H+②
H++OH- H2O③
H2O③
由于N水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+OH- NH3·H2O②
NH3·H2O②
由于NH4Cl电离出的N与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学解释只有一种正确,他选用的试剂是 (填写编号)。
| A.NH4NO3 | B.CH3COONH4 |
| C.Na2CO3 | D.NH3·H2O |
(2)请你说明丙同学作出该选择的理由是 。
(3)丙同学将所选试剂滴入Mg(OH)2悬浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。