电离度是描述弱电解质电离程度的物理量,电离度=(已电离的物质的量/原来的总物质的量)×100%。现取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为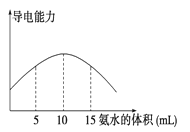
| A.0.5% | B.1.5% | C.0.1% | D.1% |
现有下列短周期元素性质的数据,下列说法正确的是
| ① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
| 原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
| 最高或最低化合价 |
-2 |
+2 |
+1 |
+5;-3 |
+7;-1 |
+1 |
+5; -3 |
+3 |
A.⑧号元素为Al
B.②、③处于同一周期
C.上述八种元素最高价氧化物对应的水化物⑤号酸性最强
D.④元素的气态氢化物沸点大于⑦元素的氢化物
一种由甲醇(CH3OH)和氧气以及氢氧化钠做电解质溶液的新型电池,关于此电池的推断正确的是
| A.通入氧气的一极是负极 |
| B.放电时,溶液中的OH- 向正极移动 |
| C.反应中若有6mol电子发生转移,则有32g CH3OH被还原 |
| D.该电池工作时甲醇一极附近溶液的pH降低 |
燃烧热是指在25℃,101kPa,1 mol可燃物完全燃烧生成稳定的化合物时放出的热量。已知热化学方程式:①CO(g)+1/2 O2(g)="=" CO2(g) ΔH=" -283.0" kJ·mol-1
②H2(g)+ 1/2O2(g)="=" H2O(g) ΔH=" -241.8" kJ·mol-1
则下列说法正确的是
| A.H2的燃烧热为241.8 kJ·mol-1 |
B.由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=" -41.2" kJ·mol-1 CO2(g)+H2(g) ΔH=" -41.2" kJ·mol-1 |
| C.H2(g)转变成H2O(g)的化学反应一定要释放能量 |
| D.根据②推知反应H2(g)+1/2O2(g)="===" H2O(l) ΔH> -241.8 kJ·mol-1 |
短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和。下列说法正确的是
A.元素A所形成的氧化物只有一种
B.元素B的最高价氧化物对应的水化物为强酸
C.元素C、D、E的最高价氧化物对应的水化物两两之间可发生反应
D.氢化物的稳定性:A>B
一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质:①石墨 ②CuCl2 ③铜粉 ④铁粉 ⑤浓盐酸 ⑥硝酸时,能够加快反应速率,又不影响产生H2总量的是
| A.②④⑤ | B.①②③⑤ | C.①③⑤ | D.①③⑤⑥ |