在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/mL,质量分数为ω,其中含有NH4+的物质的量是b mol,下列叙述正确的是
A.溶质的质量分数ω= ×100% ×100% |
B.溶质的物质的量浓度c=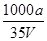 mo/L mo/L |
C.溶液中c(OH-)= mol/L+c(H+) mol/L+c(H+) |
| D.向上述溶液中加入V mL水,所得溶液的质量分数大于0.5ω |
一定温度下,在固定容积的密闭容器中,可逆反应:mA(g)+nB(g)  pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成m mol A 同时消耗q mol D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化。其中一定能说明反应已达到平衡状态的是( )
pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成m mol A 同时消耗q mol D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化。其中一定能说明反应已达到平衡状态的是( )
A.②③④⑥ B.③⑥⑦ C.②③⑥ D.③⑥
T ℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的百分含量与时间的关系如图2所示。则下列结论正确的是( )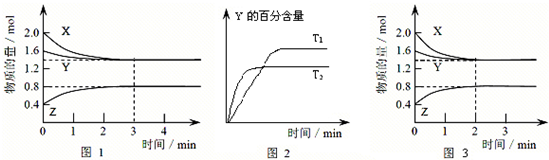
| A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·L-1·min-1 |
| B.容器中发生的反应可表示为:3X(g)+Y(g) =2Z(g) |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K增大 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
把4mol A和2.5mol B混合于2L密闭容器中,发生反应:3A(g)+2B(s)  xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol•L-1•min-1 ,下列结论错误的是( )
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol•L-1•min-1 ,下列结论错误的是( )
| A.A的平均反应速率为0.15 mol•L-1•min-1 |
| B.平衡时,C的浓度为0.25mol•L-1 |
| C.B的平均反应速率为0.1 mol•L-1•min-1 |
| D.平衡时,容器内压强为原来的0.875倍 |
对于可逆反应A(g)+2B(g) 2C(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,且使A的浓度增大,应采取的措施是()
2C(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,且使A的浓度增大,应采取的措施是()
| A.增大压强 | B.减少B的浓度 | C.减少A的浓度 | D.升高温度 |
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是( )
| A.在0-50 min之间, pH = 2和PH = 7时R的降解百分率不相等 |
| B.在 20-25 min之间, pH =" 10" 时R的平均降解速率为0.04 mol•L-1•min-1 |
| C.溶液酸性越强, R 的降解速率越小 |
| D.R的起始浓度和溶液的PH均影响R的降解速率 |