在2KI+O3+H2O===2KOH+I2+O2的反应中,当有2 mol的KI被氧化时,被还原的氧原子为
| A.1 mol | B.1/2 mol | C.2/3 mol | D.1/3 mol |
下列有关热化学方程式的叙述正确的是
| A.2H2(g)+O2(g)===2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ |
| B.已知C(石墨,s)="==" C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| C.含20.0g NAOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NAOH(Aq)+HCl(Aq)===NACl(Aq)+H2O(l);△H=-57.4 kJ/mol |
| D.已知2C(s)+2O2(g)==2CO2(g);△H1 ;2C(s)+O2(g)=2CO(g)△H2。则△H1>△H2 |
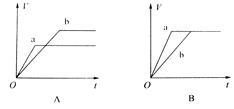
下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是
A.2SO2(g)+O2(g) 2SO3(g)△H<0 2SO3(g)△H<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H<0 4NO(g)+6H2O(g)△H<0 |
C.H2(g)+I2(g) 2HI(g)△H>0 2HI(g)△H>0 |
D.C(s)+H2O(g) CO(g)+H2(g)△H>0 CO(g)+H2(g)△H>0 |
在恒温、恒容容器中,反应A(s)+2B(g) C(g)+D(g)已达平衡状态的标志是
C(g)+D(g)已达平衡状态的标志是
| A.混合气体的压强不随时间变化而变化 |
| B.混合气体的密度不随时间变化而变化 |
| C.气体总物质的量不随时间变化而变化 |
| D.单位时间内生成n mol C,同时消耗2n mol B |
原电池反应是释放能量的氧化还原反应,下列可设计成原电池的化学反应是
| A.H2O (l)+CAO(s)=CA(OH)2(s) |
| B.BA(OH)2·8H2O+2NH4Cl=BACl2+2NH3·H2O+8H2O |
C.2KClO3 2KCl+3O2↑ 2KCl+3O2↑ |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) |
向等质量的两份锌粉A、B中,分别加入过量的稀H2SO4,同时A中加入少量的CuSO4溶液,下图中产生H2的体积(V)与时间(t)的关系基本正确的是