设NA为阿伏加德罗常数的值,下列说法正确的是
| A.2.0gH218O与D2O的混合物中所含中子数为NA |
| B.1 mol氢氧化铁胶粒所含氢氧化铁的分子数为NA |
| C.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA |
| D.足量的Fe和1mol Cl2完全反应,转移的电子数为3NA |
以下关于第IA族元素和第ⅦA族元素的有关叙述正确的是
| A.从上到下,第IA族元素单质的密度逐渐增大 |
| B.从上到下,第IA族元素单质的熔点逐渐降低 |
| C.从上到下,第ⅦA族元素其氢化物的稳定性逐渐增强 |
| D.从上到下,第ⅦA族元素其氢化物的沸点逐渐升高 |
下列关于元素周期表的说法中,错误的是( )
| A.元素周期表是元素按原子序数从小到大从左到右排列而成的 |
| B.主族元素原子的电子层数等于其所在周期的周期序数 |
| C.四、五、六周期中都含有18种元素,其中Ⅷ族中所含元素种类最多 |
| D.元素周期表中有18列、16个族,且第二列中无非金属元素 |
已知R原子有b个中子,R2+核外有a个电子。表示R原子符号正确的是( )
下列表达方式中错误的是( )
A.次氯酸电子式: 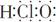 |
B.S2-的结构示意图: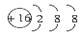 |
| C.O—18的原子符号:188O | D.CO2分子的结构式:O=C=O |
为纪念编制了第一个元素周期表的俄国化学家门捷列夫,人们把第101号元素(人工合成元素)命名为钔。下列关于了258Md和260Md的叙述正确的是
| A.258Md原子所含中子数与质子数之差为56 | B.258Md和260Md互称为同素异形体 |
| C.258Md和260Md为同一种核素 | D.有一种Md元素的相对原子质量为258 |