(1)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c(Na+)> c(CN-),用“>、<、=”符号填空
①溶液中c(OH -) c(H +)②c (HCN) c(CN-)
(2)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液的碳酸氢根离子浓度变化趋势可能是:
(A)逐渐减小;(B)逐渐增大;(C)先逐渐增大,而后减小;(D)先逐渐减小,而后增大
(3)pH值相同的HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别用0.1 mol/LNaOH(aq)中和,消耗NaOH(aq)最多的是 。
③反应开始时,反应速率 。
A、HCl最快 B、H2SO4最快 C、CH3COOH最快 D、一样快
(4)某温度下,纯水中的c(H+)= 2.0×10-7 mol/L,则此时c(OH -)= mol/L。相同条件下,测得① NaHCO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液的pH值相同。它们的物质的量浓度由大到小的顺序是 。
碘及其化合物在生产、生活和科技等方面都有重要应用。请回答下列问题:
(1)保存碘单质时应注意的问题是____。
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子:
反应②的平衡常数K=(填表达式)。
温度升高时,反应①的平衡常数将(填“增大”、“不变”或“减小”)。
(3)某化学课外小组用海带为原料制得少量含碘离子的溶液。现用该溶液进行下列实验:
①用高锰酸钾滴定法测碘离子浓度。反应为:
滴定20.00 mL该溶液需0.10 mol·L-1的酸性高锰酸钾溶液10.25 mL,则该溶液中碘离子的浓度为mol·L-1(精确到0.01)。
②用下列流程制取少量碘单质: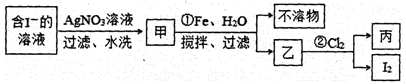
步骤①的离子方程式为,在该步骤中,加入100 mL水和足量的铁粉,充分搅拌,当消耗1.4 g Fe时,悬浊液中的c(Ag+)=。[假设实验过程中溶液体积不变;此温度下Ksp(AgI)=8.3×10-17]
(4)I2O5是白色粉末状固体,可用作氧化剂使H2S、CO、HC1等氧化,在合成氨工业中常用I2O5来定量测量CO的含量。
写出CO(g)与I2O5(s)反应析出固态I2的热化学方程式:
。
X、Y、Z、W、Q均为短周期元素,原子序数依次增大,X、Q同主族,X元素的原子半径最小,Y元素原子的最外层电子数是内层电子数的2倍,Z元素的最高价氧化物的水化物甲与其气态氢化物化合生成一种盐乙;X、Y、Z、Q四种元素都能与W元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)Q的原子结构示意图为。
(2)Y和W相比,非金属性较强的是(用元素符号表示),下列事实能证明这一结论的是____(选填字母序号)。
a.常温下,Y的单质呈固态,W的单质呈气态
b.W的气态氢化物的稳定性强于Y的气态氢化物
c.Y与W形成的化合物中,Y呈正价
d.W的最高价氧化物的水化物酸性强于Y的最高价氧化物的水化物
(3)X、Y、W、Q四种元素组成的某无机化合物,受热易分解。写出少量该化合物的溶液与足量的Ca(OH)2溶液反应的离子方程式:。
(4)常温下,甲、乙的水溶液pH均为5。则甲、乙的水溶液中由水电离出的H+浓度大小关系为:甲____乙(填“>”、“<”或“=”)。
(5)利用原电池原理,将X、Z的单质气体分别通人电池的两极,用质子导电陶瓷传递H+,可合成ZX3,该电池的正极反应式为。
A、B、C、D、E是中学常见的五种化合物,A、B是氧化物,X、Y是生活中常见的金属,相关物质间的关系如下图所示(某些条件已略去)。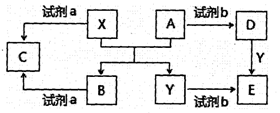
(1)若试剂a是NaOH溶液。
①C的名称是____。
②B与试剂a反应的离子方程式是。
(2)若试剂b是稀H2SO4。
①D的化学式是。
②某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料来制备Y(OH)SO4,反应中有NO生成,该反应化学方程式是:。

(1)①用1.0 mol·L-1盐酸配制100 mL 0.10 mol·L-1盐酸,所需的玻璃仪器有量筒、
100 mL容量瓶、烧杯、、。
②用0.10 mol·L-1标准盐酸滴定未知浓度的烧碱溶液时,酸式滴定管初读教为0.10
mL,终读数如右图所示,则滴定所用盐酸体积为____。
(2)如右图所示,集气瓶内充满某混合气体,置于光亮处一段时间,
将滴管内的水挤入集气瓶,再打开止水夹,烧杯中的水会进入
集气瓶。该集气瓶中的气体可能是。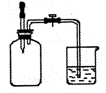
| A.CO、O2 |
| B.Cl2、CH4 |
| C.NO2、O2 |
| D.N2、H2 |
某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。向乙中滴入酚酞试液,将电源接通后,在F极附近显红色。试回答下列问题:
(1)电源A 极的名称是___________。
(2)甲装置中电解反应的 总化学方程式是
总化学方程式是
______________________________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是_________ _。
_。
(4)欲用丙装置给铜镀银,G应该是______(填“铜”或“银”),电镀液是_______(填化
学式)溶液。
(5)装置丁中的现象是________________________________________。