高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。如图是以铁屑为原料制备K2FeO4的工艺流程图:

请回答下列问题:
(1)氯气与铁屑反应生成FeCl3的条件是 ,其生成物氯化铁也可作净水剂,其净水原理为 。
(2)流程图中的吸收剂X 为 (选填字母代号)。
a.NaOH 溶液 b.Fe 粉
c.FeSO4溶液 d.FeCl2溶液
(3)氯气与NaOH 溶液反应生成氧化剂Y 的离子方程式为 。
(4)反应④的化学方程式为 ,该反应中氧化剂与还原剂的物质的量之比为 。
(5)K2FeO4的净水原理是 ,该反应生成具有吸附性的Fe(OH)3。用上述方法制备的粗K2FeO4需要提纯,可采用重结晶、洗涤、低温烘干的方法,洗涤剂可选用稀KOH 溶液,原因是 。
,该反应生成具有吸附性的Fe(OH)3。用上述方法制备的粗K2FeO4需要提纯,可采用重结晶、洗涤、低温烘干的方法,洗涤剂可选用稀KOH 溶液,原因是 。
(6)测定制备的粗K2FeO4的纯度可用滴定法,滴定时有关反应的离子方程式为:

现称取1.98 g 粗K2FeO4样品溶于适量KOH 溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液在250 mL 容量瓶中定容。每次取25.00 mL 加入稀硫酸酸化,用0.100 0 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中K2FeO4的质量分数为 。
(1)将质量比为14 :15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______,氮原子和氧原子的个数比为________,该混合气体的平均摩尔质量为___________。
(2)同温同压下,质量相同的五种气体:① CO2② H2③ O2④ CH4⑤ SO2
所占的体积由大到小的顺序是(填序号,下同)_________________;
所含原子数由多到少的顺序是__________________________;
密度由大到小的顺序是_________________________________。
(3)VmLAl2(SO4)3溶液中含Al3+ ag,取V/4mL溶液稀释到VmL,则稀释后溶液中的SO42-的物质的量浓度是(单位为mol/L)______________
(4)标准状况下将224LHCl气体完全溶于1L水中,所得溶液的密度为1.1g/cm3,则所得稀盐酸的质量分数为____________, 物质的量浓度为_________________.
用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解④转移、洗涤⑤定容、摇匀
回答下列问题
(1)所需浓硫酸的体积是,量取浓硫酸所用的量筒的规格是
(从下列中选用 A. 10ml B. 25ml C. 50ml D. 100ml)
(2)第③步实验的操作是
(3)第⑤步实验的操作是
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视溶液的液凹面
氯化钠样品含有少量的Na2SO4 和 Na2CO3,按下列流程进行净化,请在流程中的()中写上合适的试剂,在[ ]中写上实验操作名称
写出有关反应的化学方程式:
第步②
第步③
第步⑤
(1)有两瓶CCl4和水都是无色液体,只用试管,不用任何其它试剂,如何鉴别?简要写出实验方案
;
(2)有一小块外表不规则且质地坚实的碳酸钙,设计一个实验方案用以测定这种碳酸钙的密度,提供的仪器有:托盘天平,100ml 量筒,要用到的试剂可任意取用
.
绿色化学的最大特点在于从开始生产时就采取了污染防治的科学手段,实现生产过程的零污染和生产终端的零污染排放,要实现这种生产方式,就必须充分利用资源中的每一个原子,这种理想的生产方式又被称为“原子经济性”。现有甲、乙、丙3个化肥厂生产尿素,所用的原料不同,但生产的流程相似,其中第①反应都是在一定条件下含碳原料与水的反应: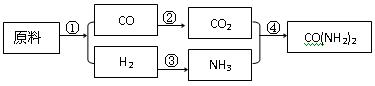
甲厂:以焦炭、空气和水为原料
乙厂:以天然气、空气和水为原料
丙厂:以石脑油(主要成分C5H12)、空气和水为原料
试回答下列问题:
(1)用化学方程式表示乙厂合成尿素的生产过程。
①_______________________________________
②_______________________________________
③_______________________________________
④_______________________________________
(2)3个化肥厂的原料利用率各不相同,试判断化肥厂对原料的利用率最高的是________,简述原因_______________________________________