下列物质属于同分异构体的一组是()
| A.葡萄糖糖和蔗糖 | B.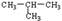 与 CH3-CH2-CH2-CH3 与 CH3-CH2-CH2-CH3 |
| C.C2H6与C3H8 | D.O2与O3 |
(附加题)已知还原性:SO32-> I一> Fe2+ > Br一,某无色溶液中可能含有I一、NH4+、Fe2+、SO32—,向该溶液中加入少量溴水,溶液呈无色。则下列关于溶液组成的判断正确的是:
①肯定不含I一②肯定不含Fe2+③肯定含有SO32—④可能含有I一⑤肯定不含NH4+
| A.②③④ | B.①②③ | C.①③ | D.③④⑤ |
将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上 _____ + ____ → _______ + _______ + _______+H2O组成一个未配平的化学方程式,正确的顺序是:
| A.FeSO4、Fe(NO3)3;Fe2(SO4)3、HNO3、N2O |
| B.Fe2(SO4)3、N2O;FeSO4、HNO3、Fe(NO3)3 |
| C.HNO3、Fe2(SO4)3;FeSO4、Fe(NO3)3、N2O |
| D.HNO3、FeSO4;Fe2(SO4)3、Fe(NO3)3、N2O |
学生设计了如图的方法对A盐进行鉴定: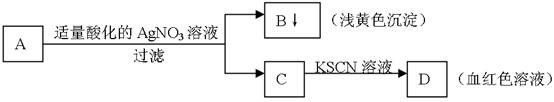 由此分析,下列结论中,正确的是:
由此分析,下列结论中,正确的是:
| A.A中一定有Fe3+ | B.C中一定有Fe3+ |
| C.B为AgI沉淀 | D.A一定为FeBr2溶液 |
从海水(含氯化镁)中提取镁,涉及如下步骤:
①将沉淀物与盐酸反应,结晶、过滤②在HCl气体氛围中干燥产物
③过滤、洗涤沉淀物④将得到的产物熔融电解得到镁
⑤把贝壳制成石灰乳[Ca(OH)2],在引入的海水中加入石灰乳,沉降。
下列说法正确的是:
| A.正确操作步骤的顺序是⑤②③①④ |
| B.步骤④电解时阴极产生氯气 |
| C.直接在空气中将MgCl2溶液蒸干可得到Mg(OH)2高网 |
| D.此法提取镁的过程中涉及置换、分解、化合和复分解反应资 |