五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)。
| 元素代号 |
X |
W |
Y |
Z |
Q |
| 原子半径(×10-12 m) |
37 |
64 |
66 |
70 |
154 |
| 主要化合价 |
+1 |
-1 |
-2 |
+5、-3 |
+1 |
下列说法正确的是
A.由Q与Y形成的化合物中只存在离子键
B.Z与X之间形成的化合物具有还原性
C.由X、Y、Z三种元素形成的化合物,其晶体一定是分子晶体
D.Y与W形成的化合物中,Y显负价
现有常温下的四份溶液:①0.01 mol·L-1 CH3COOH溶液;②0.01 mol·L-1盐酸;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
| A.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 |
| B.①中水的电离程度最小,③中水的电离程度最大 |
| C.将四份溶液稀释相同倍数后,溶液的pH:④>③,①>② |
| D.将②、③混合,若pH=7,则消耗溶液的体积:②<③ |
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随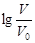 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是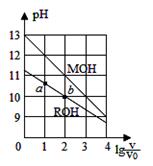
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当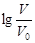 =2时,若两溶液同时升高温度,则 =2时,若两溶液同时升高温度,则  增大 增大 |
室温下,向20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是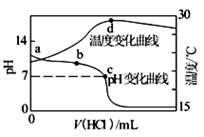
| A.氨水的电离程度a>b>c |
| B.a、d两点的溶液,水的离子积Kw(a)>Kw(d) |
| C.c点时消耗盐酸体积V(HCl)<20.00ml |
| D.d点时溶液温度达到最高,之后温度略有下降,原因是NH3·H2O电离吸热 |
水的电离平衡为H2O H+﹢OH-,△H>0,下列叙述不正确的是
H+﹢OH-,△H>0,下列叙述不正确的是
| A.将水加热,pH减小 |
| B.恒温下,向水中加入少量固体KOH,Kw不变 |
| C.向水中滴入稀醋酸,c(H+)增大 |
| D.向水中加入少量固体NaClO,平衡逆向移动 |
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.在稀硫酸中加入少量氢氧化钠固体,溶液导电性增强 |
| B.饱和碳酸钠溶液中:c(Na+)=2c(CO32-) |
| C.饱和食盐水中:c(Na+) + c(OH-)c(Cl-)+ c(H+) |
| D.pH=12的NaOH溶液中:c(OH-)=1.0×10-2 mol·L-1 |