25℃时,水的电离达到平衡:H2O≒H++OH﹣△H>0,下列叙述正确的是
| A.向水中加入氢氧化钠,平衡逆向移动,c(H+)降低,c(OH﹣)增大 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,c(H+)不变 |
向某稀HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体,该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如图所示。则稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为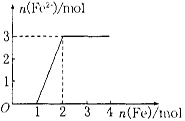
| A.2:1 | B.4:1 | C.1:1 | D.3:1 |
14g铜金合金与足量的某浓度HNO3反应,将产生的气体用1.12L(标准状况)O2 混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为
| A.9.6g | B.6.4g | C.3.2g | D.1.6g |
将硫酸铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则原硫酸铝溶液和氢氧化钠溶液的物质的量之比可能是①1∶3 ②2∶3 ③1∶7 ④2∶7 ⑤任意比
| A.②③ | B.只有① | C.②④ | D.①③ |
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32−、SO42−、NO3−中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。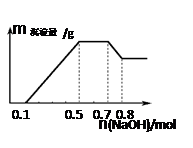
则下列说法正确的是
| A.溶液中的阳离子只有H+、Mg2+、Al3+ |
| B.溶液中n(NH4+)=0.2mol |
| C.溶液中一定不含CO32−,可能含有SO42−和NO3− |
| D.三种离子的物质的量之比:n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1 |
1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质为
| A.Na2CO3 | B.Na2O2、Na2CO3 |
C.NaOH、Na2CO3 | D.Na2O2、NaOH、Na2CO3 |