微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,
电极反应式为:Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-,
总反应式为:Ag2O+Zn===ZnO+2Ag 根据上述反应式,判断下列叙述中正确的是
| A.在使用过程中,电池负极区溶液的pH增大 |
| B.在使用过程中,电子由Ag2O经外电路流向Zn极 |
| C.Zn是负极,Ag2O是正极 |
| D.Zn极发生还原反应,Ag2O极发生氧化反应 |
根据下图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法正确的是
| A.该反应中反应物所具有的总能量高于生成物所具有的总能量 |
| B.2 mol N原子结合生成N2(g)时需要放出946 kJ能量 |
| C.1 mol NO(g)分子中的化学键断裂时需要放出632 kJ能量 |
| D.该反应的热化学方程式为:N2+O2=2NO △H=+180 kJ/mol . |
下列说法正确的是
| A.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
| B.用溴水鉴别苯和正己烷 |
| C.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 |
| D.乙烯和苯都能使溴水褪色,褪色的原因不相同 |
下列关于电化学的说法中错误的是
| A.原电池的负极、电解池的阳极均发生氧化反应 |
| B.原电池将化学能转化为电能,电解池将电能转化为化学能 |
| C.电解水制取H2和O2时,为了增强导电性,可加入NaOH、NaCl、H2SO4 |
| D.利用原电池原理可制备化学电源,利用电解池原理可制备化学物质 |
已知一定温度时:N2(g)+3 H2(g) 2NH3(g)。当生成2molNH3时,放出热量为92kJ,在相同温度和压强下,向密闭容器中通入1mol N2和3mol H2,达到平衡时放出热量为Q。则下列关系式中正确的是
2NH3(g)。当生成2molNH3时,放出热量为92kJ,在相同温度和压强下,向密闭容器中通入1mol N2和3mol H2,达到平衡时放出热量为Q。则下列关系式中正确的是
| A.Q=92 kJ | B.Q< 92 kJ | C.Q> 92 kJ | D.Q=194kJ |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是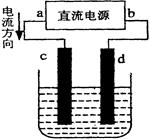
| A.d为负极、c为正极 |
| B.c电极上有气体产生 |
| C.电解过程中,Cu2+在溶液中向c棒迁移 |
| D.电解过程中,d电极质量不变,氯离子浓度不变 |