下列各反应的离子方程式书写中,正确的是
| A.金属钠投入水中:Na+2H2O═Na++OH-+H2↑ |
| B.用FeCl3溶液腐蚀铜线路板:Cu+Fe3+═Cu2++Fe2+ |
| C.向Na2CO3溶液中加入过量CH3COOH溶液:CO32-+2H+═CO2↑+H2O |
| D.过量CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O═HCO3-+HClO |
在两个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如下图所示。
C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如下图所示。
下列说法正确的是
| A.该反应的ΔH>0 |
| B.氢碳比:X<2.0 |
| C.在氢碳比为2.0时,Q点v(逆)小于P点的v(逆) |
| D.P点温度下,反应的平衡常数为512 |
已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+ H2O  H2SO3 + OH- ①
H2SO3 + OH- ①
HSO3- H+ + SO32- ②
H+ + SO32- ②
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
| A.加入少量固体NaOH,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 |
| B.加入等体积等浓度Na2SO3溶液,则3c(Na+) = 2[c(HSO3-) + c(H2SO3) +c(SO32-)] |
C.加入少量NaOH溶液, 、 、 的值均增大 的值均增大 |
| D.加入氨水至中性,则2c(Na+) = c(SO32-)>c(H+) = c(OH-) |
25℃时,用0.1mol/L的CH3COOH溶液滴定20mL0.1 mol/L的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确的是
A.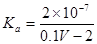 |
B.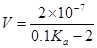 |
C. |
D.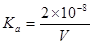 |
下列实验装置正确的是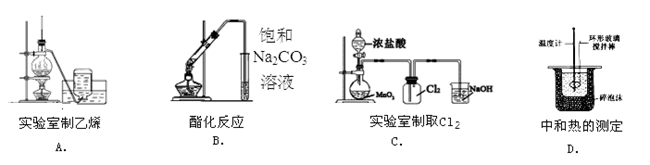
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列推断正确的是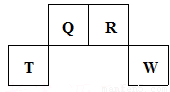
| A.T的硫酸盐溶液可作为自来水的消毒剂 |
| B.Q与氢形成的化合物均含极性共价键 |
| C.R的最高正价氧化物的水化物是弱电解质 |
| D.W的氢化物的沸点高于同族的上一周期的氢化物的沸点 |