在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g) 1/2N2(g)+CO2(g);△H=-373.2kJ•mol-1,达到平衡后,为提高该反应的速率和NO的转化率,正确措施是
1/2N2(g)+CO2(g);△H=-373.2kJ•mol-1,达到平衡后,为提高该反应的速率和NO的转化率,正确措施是
| A.加催化剂同时增大压强 | B.加催化剂同时升高温度 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
在下列溶液中,各组离子一定能够大量共存的是
| A.含有大量Al3+的溶液: Na+、Cl-、AlO2-、OH- |
| B.常温下c(H+)/c(OH-)=1012的溶液:Fe2+、Mg2+、NO3-、Cl- |
| C.能使广泛pH试纸显蓝紫色的溶液:K+、Ba2+、Cl-、Br- |
| D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
漂白粉和泡腾片用于环境消毒和饮用水消毒,已知泡腾片消毒原理如下图:下列有关说法不正确的是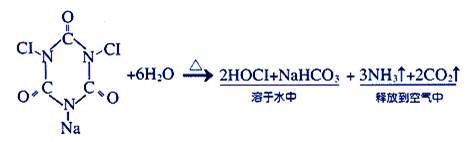
| A.漂白粉需密闭储存 |
| B.工业上制取漂白粉可将氯气通入石灰乳中制得 |
| C.泡腾片主要成分属于有机物 |
| D.泡腾片分子中氮显+3价 |
当压力达到220atm、温度达到374℃时,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,这就是“水热反应”,生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法不正确的是
| A.二氧化碳与超临界水作用生成汽油的反应,属于放热反应 |
| B.“水热反应”是一种复杂的物理化学变化 |
| C.火力发电厂可以利用废热,将二氧化碳转变为能源物质 |
| D.随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环 |
有3个热化方程式:H2(g)+1/2O2(g)=H2O(g);△H ="a" kJ/mol
H2(g)+1/2O2(g)=H2O(l);△H =bkJ/mol
2H2(g)+O2(g)=2H2O(l);△H =ckJ/mol
关于它们的下列表述正确的是()
| A.a+b=c |
B.1mol H2O由气态变为液态吸收(a-b)kJ热量 |
C.氢气的燃烧热为c/2 kJ |
| D.1molH2 O由液态变为气态吸收l c/2-al kJ热量 |
向三份0.lmol/L NaHCO3溶液中分别加入少量冰醋酸、Ca(OH)2、NaA1O2固体(忽略溶液体积变化),则溶液中CO32-浓度的变化依次为()
| A.减小、减小、增大 | B.减小、增大、增大 |
| C.增大、减小、减小 | D.减小、减小、减小 |