已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为________________;A、B、C的电负性由大到小的顺序为___________;(均用“<”或“>”连接)
(2)B的氢化物的分子空间构型是_____________。其中心原子采取_____________杂化。
(3)写出化合物AC2的电子式____________;一种由B、C组成的化合物与AC2互为等电子体,其化学式为____________。
(4)E的价层电子排布式是____________,在形成化合物时它的最高化合价为_____________,ECl3形成的配合物的化学式为________________。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是________________。
乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。
请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)甲烷中混有乙烯,欲除乙烯得到纯净的甲烷,可依次将其通过下列哪试些剂的洗气瓶( )
| A.澄清石灰水,浓H2SO4 | B.溴水,浓H2SO4 |
| C.酸性高锰酸钾溶液,浓H2SO4 | D.浓H2SO4,酸性高锰酸钾溶液 |
(3)写出乙烯与溴水的反应_____________________,反应类型为_________反应。
元素的电负性的大小可以作为判断元素金属性与非金属性强弱的尺度。下表列出部分短周期元素的电负性。请回答下列问题。
| 元素 |
Al |
B |
Be |
C |
Cl |
X |
Li |
| 电负性 |
1.5 |
2.0 |
1.5 |
2.5 |
3.0 |
4.0 |
1.0 |
| 元素 |
Mg |
N |
Y |
O |
P |
S |
Si |
| 电负性 |
1.2 |
3.0 |
0.9 |
3.5 |
2.1 |
2.5 |
1.8 |
(1)根据上表给出的数据,可知元素的电负性越大,____(填“金属性”或“非金属性”)越强。
(2)推测Y 为____(填元素符号),用电子式表示X元素与Y元素的化合物的形成过程____________。
某氮肥厂氨氮废水中氮元素多以NH4+和NH3·H2O的形式存在,该废水的处理流程如下:
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用:。
(2)过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如右:第一步反应是反应(选填“放热”或“吸热”),1molNH4+(aq)完全转化成NO3-(aq)共与环境交换了 __________kJ热量。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32g CH3OH转移6 mol电子,则生成的N2物质的量是。
下列物质中:
(1)互为同分异构体的有;(2)互为同素异形体的有;
(3)互为同位素的有;(4)互为同系物的有___________。(填序号)
①石墨②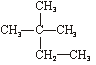 ③C60④CH4⑤
③C60④CH4⑤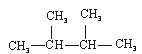 ⑥
⑥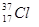 ⑦
⑦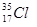 ⑧金刚石⑨C3H6⑩C4H10
⑧金刚石⑨C3H6⑩C4H10
下图是元素周期表中一部分
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)④、⑤、⑥的原子半径由大到小的顺序为(填元素符号)
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)
(3)①、④、⑤中的元素可形成既含离子键又含极性共价键的化合物,写出化合物的电子式为,由表中②、④两种元素的原子按1:2组成的化合物的结构式为_________________。