甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
| 化学键 |
H-H |
C-O |
C≡O |
H-O |
C-H |
| E/(kJ·mol-1) |
436 |
343 |
1076 |
465 |
413 |
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1= kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3= kJ.mol-1
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。

(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: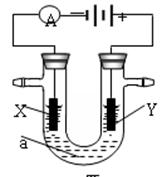
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为。
在X极附近观察到的实验现象是。
②Y电极上的电极反应式为。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是,电极反应式为。
②Y电极的材料是,电极反应式为。(说明:杂质发生的电极反应不必写出)
电解一段时间后,CuSO4溶液的浓度将(填“变大”、“变小”或“不变”)
(1)下图是工业氮气和氢气合成1mol氨气过程中能量变化示意图,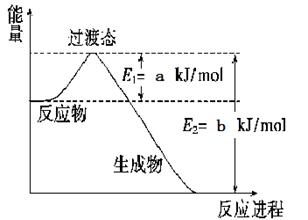
请写出该反应的热化学方程式。
(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=C02(g)△H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H=____。
(3)将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如下图所示。
正极上发生的电极反应为___
阴极上发生的电极反应为___
(4)如图是甲烷燃料电池原理示意图,回答下列问题: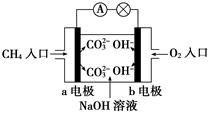
①电池的负极是________(填“a”或“b”)极,负极的电极反应式是___。
②电池工作一段时间后电解质溶液的pH______(填“增大”、“减小”或“不变”)
苯乙烯是重要的基础有机化工原料。工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH= CH2)的反应方程式为:
C6H5-CH2CH3 (g) C6H5-CH=CH2 (g) +H2(g)ΔH1=+125kJ•mol﹣1
C6H5-CH=CH2 (g) +H2(g)ΔH1=+125kJ•mol﹣1
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示: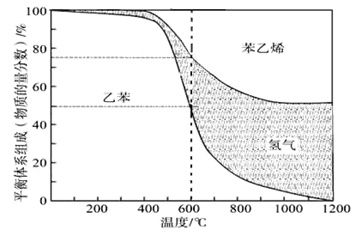
600℃时,由上图可知:
①氢气的物质的量分数为。
②此温度下该反应的平衡常数。
(2)分析上述平衡体系组成与温度的关系图:
当温度高于970℃,苯乙烯的产率不再增加,其原因可能是。
(3)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。C6H5C2H5的平衡转化率与水蒸气的用量、体系总压强关系如下图。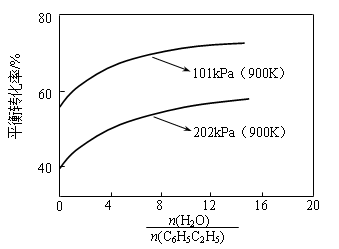
加入稀释剂能影响C6H5C2H5平衡转化率的原因是:______________________________。
(4)某些工艺中,在反应的中途加入O2和特定的催化剂,有利于提高C6H5C2H5的平衡转化率。试解释其原因______________________________________________。
(5)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率30%
(6)乙苯在特定催化剂下发生氧化脱氢:
C6H5-CH2CH3 (g)+ 1/2O2(g) C6H5-CH=CH2 (g) +H2 O (g) ΔH
C6H5-CH=CH2 (g) +H2 O (g) ΔH
已知 H2的燃烧热ΔH为-285.8KJ/mol,水的汽化热为2441.12焦耳/克,则 ΔH=。
I、常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
(1)在同一溶液中,H2CO3、HCO3-、CO32-(填:“能”或“不能”)大量共存。
(2)已知在25℃时,CO32-水解反应的平衡常数(即水解常数用Kh表示)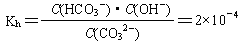
当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=。
(3)当混合液的pH=________时,开始放出CO2气体。
II、(1)常温下向25mL含HCl 0.01mol的溶液中滴加氨水至过量,该过程中水的电离平衡____________________(填写电离平衡移动情况)。当滴加氨水到25mL时,测得溶液中水的电离度最大,则氨水的浓度为______________。
(2)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“>”、“<”或“=”)。
(3)25 ℃时,将a mol NH4NO3溶于水,向所得溶液中滴加b L氨水后溶液呈中性,则所滴加氨水的浓度是________mol·L-1。(用含a 、b 的式子表示)(NH3·H2O的电离平衡常数取Kb=2×10-5 mol·L-1)
(10分)A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH 、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1xL B溶液、0.001mol·L-1yL D溶液充分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是溶液。
(2)用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是(填写序号)
①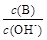 ;②
;② ;
;
③c(H+)和c(OH-)的乘积④OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
①反应所需要的时间E>A②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中的_________曲线(填写序号)。
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为。