FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为 。
②完成NaClO3氧化FeCl2的离子方程式:_____ClO3-+______Fe2++______=_____Cl-+_____Fe3++______
(3)FeCl3在溶液中分三步水解:Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2 Fe(OH)++H2O
Fe(OH)2++H+ K2 Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体。X为周期表前四周期中电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出QT2+时的电子式:________,基态Z原子的核外电子排布式为________。
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有________等两种。
(3)化合物甲由T、X两元素组成,其晶胞如图1所示,甲的化学式为____。
(4)化合物乙的晶胞如图2所示,乙由E、Q两元素组成,硬度超过金刚石。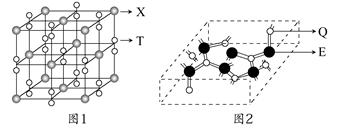
①乙的晶体类型为________,其硬度超过金刚石的原因是________。
②乙的晶体中E、Q两种元素原子的杂化方式均为________。
A、B、C、D、E、F六种元素的原子序数依次递增。
已知:①F的原子序数为25,其余的均为短周期元素;②元素A与元素B同周期,元素A与元素E同主族,且A、B、E三种原子p轨道上均有2个未成对电子;③元素C、D、E在同一周期,且C原子中没有未成对电子。
请回答下列问题:
(1)元素A与元素B的电负性大小比较为:________>________;元素C与元素D的第一电离能的大小比较为:________>________(填入相应的元素符号)
(2)F的核外电子排布式为________。
(3)元素B与元素E形成的晶体所属的晶体类型为________晶体,在该晶体中原子间形成的共价键属于________(从下列选项中选出正确类型)。
A.σ键 B.π键 C.既有σ键,又有π键
(4)由氢元素与A、B两元素共同构成的相对分子质量为30的分子里,中心原子的杂化轨道类型为________,分子的空间构型为________.
(5)根据等电子原理,写出由元素A与元素B构成的一种双原子极性分子的结构式:________。
Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1,3,6,6,且都含有18个电子,B、C由两种元素的原子组成,且分子中两种原子的个数比均为1:2,D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是________。
(2)从B分子的立体结构判断,该分子属于________分子(填“极性”或“非极性”)。
(3)1个C分子中包含________个σ键。
(4)D的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明D是何物质):________。
Ⅱ.CO的结构可表示为CO,N2的结构可表示为NN。
(5)下表是两者的键能数据(单位:kJ·mol-1):
| A—B |
A=B |
A≡B |
|
| CO |
357.7 |
798.9 |
1071.9 |
| N2 |
154.9 |
418.4 |
941.7 |
结合数据说明CO比N2活泼的原因:________。
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为________,基态Cu原子的价电子排布式为________。
(7)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________(填晶体类型)。
氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为________。氧元素与氟元素能形成OF2分子,该分子的空间构型为________。
(2)根据等电子原理,在NO2+离子中氮原子轨道杂化类型是________;1 mol O22+中含有的π键数目为________个。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为________。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其晶体结构如图所示,则该钙的氧化物的化学式为________。
(5)下列物质的分子与O3分子的结构最相似的是________。
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(6)O3分子是否为极性分子?________。
LED照明是我国制造业为人类做出的一大贡献。目前市售LED晶片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如下图。试回答: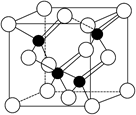
(1)镓的基态原子的电子排布式是__________。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为__________,与同一个镓原子相连的砷原子构成的空间构型为__________。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是__________。(用氢化物分子式表示)
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为__________。
(5)比较二者的第一电离能:As__________Ga(填“<”、“>”或“=”)。
(6)下列说法正确的是__________(填字母)。
| A.砷化镓晶胞结构与NaCl相同 |
| B.GaP与GaAs互为等电子体 |
| C.电负性:As>Ga |
| D.砷化镓晶体中含有配位键 |