用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过 程如下图所示,分析判断________段化学反应速率最快,这段反应速率最快的原因是 。
程如下图所示,分析判断________段化学反应速率最快,这段反应速率最快的原因是 。
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是
| A.蒸馏水 | B.氯化钠固体 | C.氯化钠溶液 | D.浓盐酸 |
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(回答一种即可)
。
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。请回答:
⑴在④操作中用到的量取仪器是。以上步骤有错误的是(填编号),该错误操作会导致测定结果有误差。下列操作会造成同样的测定结果的是。
①锥形瓶用待测溶液润洗②滴定前读数正确,滴定后俯视读数
③碱式滴定管滴定前无气泡,滴定终点时有气泡④滴定前读数正确,滴定后仰视读数
⑤配制NaOH溶液时,称量的NaOH中含NaCl⑥振荡锥形瓶时部分液体溅出
⑵如下图是某次滴定时的滴定管中的液面,其读数为mL。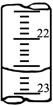
Ⅰ:利用水煤气合成二甲醚的三步反应如下:
①2H (g)+CO(g)
(g)+CO(g) CH
CH OH(g);ΔH=-90.8 kJ·mol
OH(g);ΔH=-90.8 kJ·mol
②2CH OH(g)
OH(g) CH
CH OCH
OCH (g)+H
(g)+H O(g);ΔH=-23.5 kJ·mol
O(g);ΔH=-23.5 kJ·mol
③CO(g)+H O (g)
O (g) CO
CO (g)+H
(g)+H (g);ΔH=-41.3 kJ·mol
(g);ΔH=-41.3 kJ·mol
总反应:3H (g)+3CO(g)
(g)+3CO(g) CH
CH OCH
OCH (g)+CO
(g)+CO (g)的ΔH=__________:
(g)的ΔH=__________:
Ⅱ:如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有饱和NaCI溶液。
①甲中石墨棒上的电极反应式__________,电子的移动方向为________;
②乙中总反应的离子方程式为__________,Cl 移向__________电极(填Fe或C);
移向__________电极(填Fe或C);
③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl 氧化了生成的I
氧化了生成的I 。若反应中Cl
。若反应中Cl 和I
和I 的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:_____________________;
的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:_____________________;
(2)若甲、乙两烧杯中均盛有CuSO 溶液。
溶液。
①甲中铁棒上的电极反应式为:______________________;
②如果起始时乙中盛有200 mL pH=5的CuSO 溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_________(填写物质的化学式)_________g。
溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_________(填写物质的化学式)_________g。
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H (g)
(g) CH
CH OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H
OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H 和一定量的CO后,CO和CH
和一定量的CO后,CO和CH OH(g)的浓度随时间变化。请回答下列问题:
OH(g)的浓度随时间变化。请回答下列问题:
(1)在“图1”中,曲线______(填:a或b)表示使用了催化剂;该反应属于____________(填:吸热、放热)反应。
(2)下列说法正确的是____________________。
| A.起始充入的CO为2mol |
| B.增加CO浓度,CO的转化率增大 |
| C.容器中压强恒定时,反应已达平衡状态 |
D.保持温度和密闭容器容积不变,再充入1molCO和2molH ,再次达到平衡时n(CH3OH)/n(CO)会减小 ,再次达到平衡时n(CH3OH)/n(CO)会减小 |
(3)从反应开始到建立平衡,v(H )=__________;该温度下CO(g)+2H
)=__________;该温度下CO(g)+2H (g)
(g) CH
CH OH(g)的化学平衡常数为____________________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数__________(填“增大”、“减小”或“不变”)。
OH(g)的化学平衡常数为____________________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数__________(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线。要求画压强不同的2条曲线(在曲线上标出P 、P
、P ,且P
,且P <P
<P )。
)。
根据如图回答问题: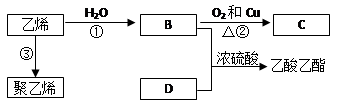
(1)写出下列物质的结构简式:BCD
(2)写出反应①的化学方程式:,反应类型:
(3)写出反应②的化学方程式:,Cu的作用是:。
2008年9月,我国爆发了三鹿婴幼儿奶粉受污染事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症,经调查发现三鹿牌婴幼儿配方奶粉中加入了有毒的三聚氰胺(化学式为 C3N3(NH2)3)牛奶和奶粉都要按规定检测蛋白质的含量,通用的蛋白质测试方法是“凯氏定氮法”,即通过测出含氮量来估算蛋白质含量。牛奶和奶粉添加三聚氰胺,主要是因为它能提高含氮量,冒充蛋白质。
(1)三聚氰胺相对子质量是_______。其含氮的质量分数为_______。
(2)各个品牌奶粉中蛋白质含量为15-20%,蛋白质中含氮量平均为16%。以某合格奶粉蛋白质含量为18%计算,含氮量为2.88%。如果三鹿牌奶粉1袋(400 g)中加了1 g三聚氰铵,相当于蛋白质含量增加了 %