有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,可证明滤液中含Na+,不含K+。
由上述现象推断:
(1)该混合物中一定含有 ;一定不含有 ,可能含有 。
(2)如要检验可能含有的物质是否存在,将如何操作
V、W、X、Y、Z是五种常见元素,其中V、W、X、Y四种短周期元素在周期表中的位置如下图所示:V、W的最简单气态氢化物M、N混合时有白烟生成,M能使湿润的pH试纸变蓝。Z是人体血红蛋白中存在的金属元素。请填写下列空白:
(1)W的原子结构示意图为;
(2)二氧化钛(TiO2)与X的单质、Y的单质高温下反应生成两种化合物,这两种化合物均由两种元素组成。其反应的化学方程式为;
(3)含X元素的一种化合物A与Y的最高价氧化物C之间有如下的反应关系: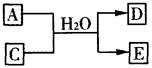
若E为白色沉淀,则E物质的化学式为;
(4)常温下,相同浓度 X、Z简单离子的溶液中滴加NaOH溶液,X、Z两元素先后沉淀,X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,则Ksp[X(OH)n](填“>”或 “<”) Ksp[Z(OH)n];
(5)Y与氢能形成多种化合物,其中一种为Y2H2。2.00g Y2H2完全燃烧生成液态水和二氧化碳,放出99.6kJ热量,写出Y2H2燃烧的热化学反应方程式________________________________________________________;
(6)同温同压下,将a L M气体和b LN气体通入水中,若所得溶液的pH=7,则ab(填“>"或“<”或“=”)。
钒的用途十分广泛,有金属“维生素”之称。某工厂为了从含有杂质的VOSO4样品中回收得到催化剂V2O5,设计流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是(写化学式)。NH4VO3在焙烧前要洗涤2-3次,该步操作方法为。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层)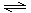 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
步骤②中萃取时必须加入适量碱,其原因是。
步骤③中X试剂为。
(3)⑤的离子方程式为。
(4)该工艺流程中,可以循环利用的物质有和。
(5)若取VOSO4样品wg,测得消耗a mol·L—1氯酸钾溶液VmL(氯酸钾还原产物为氯化钾),则1kg样品理论上可制得的V2O5质量是g(用含w、V的代数式表示)。
某人工合成香料H,其合成路线可简单表示如下: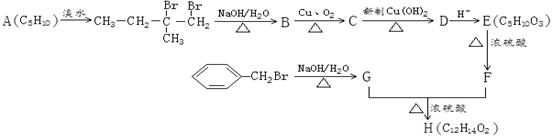
已知:F的分子结构中含有2个甲基。
请回答下列问题:
A的名称(系统命名)是;C中官能团的名称为。
E→F的反应类型是;H的结构简式是。
C→D的化学方程式是;
E在一定条件下生成的高分子化合物的结构简式为。
X是F的同分异构体,它同时符合下列3个条件,则X可能的结构简式为、(写出任意两种)。
①能发生水解反应 ②不含甲基③能发生银镜反应
常见元素X、Y、Z、W的原子序数依次增大,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子核外只有三个能级,且各能级电子数相等 |
| Y |
Y的基态原子最外层电子数是其内层电子总数的2.5倍 |
| Z |
Z的基态价电子结构为nsn-1 |
| W |
W单质常在火山口附近被发现,其氧化物是造成酸雨的主要原因之一 |
(1)Y位于元素周期表第周期族,其基态原子未成对电子有个。
(2)X的电负性比W的(填“大”或“小”);Y的最简单气态氢化物比X的最简单气态氢化物易液化,其主要原因是。
(3)Z与同周期左右相邻的两种元素的原子相比较,三者第一电离能由大到小的顺序为(用元素符号表示)。Y和Z形成的化合物为晶体,该物质遇水强烈水解的化学方程式为。
(4)在一定温度下,向一个容积不变的密闭容器中充入1molY2和3mol氢气,发生反应:Y2(g)+3H2(g) 2YH3(g)ΔH=-akJ/mol。在该条件下达到平衡时放出的热量为bkJ,其平衡常数表达式K=。若起始向此容器中充入2molYH3,在相同温度下达到平衡时,反应过程中吸收的热量为ckJ,则a、b、c三者之间的关系为(用一个式子表示)。
由苯乙烯经下列反应可制得F、K两种高分子化合物,它们都是常用的塑料。
(1)J中所含官能团的名称为;K中所含官能团的结构简式为
(2)聚合物F的结构简式是;I的分子式是。
(3)E转化为G的化学方程式是;反应类型属于
(4)在一定条件下,两分子J能脱去两分子水形成一种六元环状化合物,写出该化合物的结构简式。
(5)写出J 的一种符合下列条件的同分异构体X结简式。
①1mol X可以与3mol NaOH反应 ②X分子中氢原子核磁共振氢谱有4个峰,