下列叙述中,不能用平衡移动原理解释的是
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| D.黄绿色的氯水光照后颜色变浅 |
体积相同的某植物营养液两份,其配方如下:
| KCl |
K2SO4 |
ZnSO4 |
ZnCl2 |
|
| A |
0.3mol/L |
0.2mol/L |
0.1mol/L |
/ |
| B |
0.1mol/L |
0.3mol/L |
0.1mol/L |
下列说法正确的是
A、仅c(K+)相同 B、仅c(Cl-) 相同 C、完全相同 D、完全不同
相同 C、完全相同 D、完全不同
若氖原子质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是
| A.该氖原子的相对原子质量是12a/b |
| B.该氖原子的摩尔质量是aNAg |
C.Wg该氖原子的物质的量是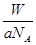 mol mol |
| D.Wg该氖原子所含质子数是10W/a |
由CO2、H2、CO组成的混合气在同温同压下与氮气的密度相同,则该混合气中CO2、H2、CO的体积比是
| A.29:8:1 | B.21:1:14 | C.13:8:29 | D.26:6:17 |
设NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.1 mol NH4+所含质子数为10NA |
| B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.01NA |
| C.标准状况下,22.4 L SO2所含原子数为NA |
| D.常温常压下,32g O2和O3的混合气体所含原子数为2NA |
下列实验基本操作(或实验注意事 项)中,主要是处于实验安全考虑的是
项)中,主要是处于实验安全考虑的是
A.实验剩余的药品不能放回原试剂瓶 B.可燃性气体的验纯
C .气体实验装置在实验前进行气密性检查 D.滴管不能交叉
.气体实验装置在实验前进行气密性检查 D.滴管不能交叉 使用
使用