自2013年3月我国北方地区出现了雾霾天气,其产生的原因说法不一,汽车的尾气排放被称为原因之一,有关氮的化合物的研究是一项重要课题。
(1).已知N2(g)+O2(g)=2NO(g) ΔH=+180.5KJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH= -566.0 KJ·mol-1
则加催化剂处理汽车尾气的热化学方程是
(2).反应2NO2(g) 2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
| 时间(s) |
0 |
10 |
20 |
25 |
30 |
| 条件A [n(NO2)](mol) |
0.20 |
0.14 |
0.13 |
0.13 |
0.13 |
| 条件B [n(NO2)](mol) |
0.20 |
0.10 |
0.10 |
0.10 |
0.10 |
①条件A与条件B表示的是该反应在某不同条件的反应状况,该不同条件是
A.有、无催化剂 B.温度不同 C.压强不同 D.容器体积不同
②能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO) B.c(NO2)=c(NO) C.O2的物质的量不变
D.混合气体的密度不变 E.混合气体的平均摩尔质量
③在条件A从反应开始至10s时,氧气的平均速率为 mol·L-1·s-1
④在条件B不变保持压强不变的条件下,向平衡体系里再通入0.15molO2和0.1molNO2,则反应 (填“正向”、“逆向”或“不移动”)。
(1)写出下列物质在水溶液中电离的方程式
HNO3HClO
NaHCO3
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________。
(3)己知:①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+ O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
回答下列问题:
①上述反应中属于放热反应的是_________________。
②H2的燃烧热为_______________,C的燃烧热为__________________.
③燃烧l0gH2生成液态水,放出的热量为_________________.
④CO的燃烧热为___________,其热化学方程式为_______________________.
(14分)金刚烷是一种重要的化工原料,工业上可通过下列途径制备: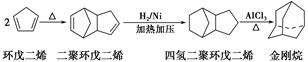
请回答下列问题:
(1)环戊二烯分子中最多有______个原子共平面。
(2)金刚烷的分子式为__________。
(3)下面是以环戊烷为原料制备环戊二烯的合成路线: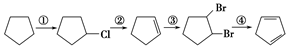
其中,反应②的反应试剂和反应条件是___________,反应③的反应类型是____________,反应④的化学方程式为。
(4)已知烯烃能发生如下反应: 。
。
请写出下列反应产物的结构简式: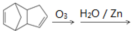 ____________________________。
____________________________。
(5)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经酸性高锰酸钾溶液加热氧化可以得到对苯二甲酸( )[提示:苯环上的烷基(—CH3,—CH2R,—CHR2)或烯基侧链经酸性高锰酸钾溶液氧化得羧基(—COOH)]
)[提示:苯环上的烷基(—CH3,—CH2R,—CHR2)或烯基侧链经酸性高锰酸钾溶液氧化得羧基(—COOH)]
写出A所有可能的结构简式(不考虑立体异构):___________________________________。
有A、B、C、D、E五种元素,其相关信息如下:
| 元素 |
相关信息 |
| A |
A原子的1s轨道上只有1个电子 |
| B |
B是电负性最大的元素 |
| C |
C基态原子的2p轨道中有3个未成对电子 |
| D |
D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
| E |
E的+1价离子的M能层中所有能级各轨道都有电子且没有未成对电子 |
请回答下列问题:
(1)写出元素E的基态原子的电子排布式_________________。
(2)CA3分子中C原子的杂化类型是________;在元素E的硫酸盐溶液中逐渐通入CA3,可以观察到的实验现象是,发生的有关反应的离子方程式为。
(3)C与A还可形成C2A4、CA5等化合物,二者都能与盐酸反应。则C2A4与盐酸反应的离子方程式为。CA5还可与水反应产生无色气体,且所得溶液显碱性,则CA5的电子式为,与水反应的化学方程式。
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有____(填序号);
1mol该离子中含有个σ键。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为_________(填序号)。
a.平面正方形B.正四面体 c.三角锥形 D.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示。
其中D离子的配位数为 ________,该晶体的化学式为__________。
下表是元素周期表的一部分,表中所列字母分别代表一种化学元素。请用元素符号等化学用语回答下列有关问题: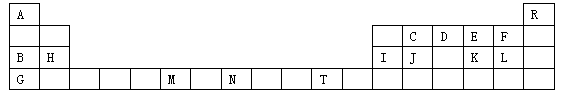
(1)上述元素中第一电离能最大的元素是,C、D、E、F四种元素第一电离能由大到小的顺序。
(2)由A、C、D形成的ACD分子中,σ键个数∶π键个数=________。
(3)要证明太阳上是否含有R 元素,可采用的方法是。
(4)能够说明K、F两元素非金属性强弱的事实是;若欲用一个简单实验证明H、I两种元素金属性的强弱,其实验方法是。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。已知MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是_____(填“极性”或“非极性”)分子。
(6)C、D两种元素,C的气态氢化物难溶于水,而D的气态氢化物却极易溶于水,
其原因是。
(7)在元素N的低价硫酸盐溶液中,加入少量由元素G、L、E组成的化合物(原子个数比为1:1:1),观察到的现象是;有关反应的离子方程式为。
有浓度为0.1 mol•L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+) 依次为a mol•L-1,b mol•L-1,c mol•L-1,大小顺序为______。
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为n1 mol,n2 mol,n3 mol,它们的大小关系为____________。
(3)中和等量NaOH溶液都生成正盐时,分别需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为___________________________________________。
(4)与等量锌反应时产生氢(气)的速率分别为v1、v2、v3,其大小关系为________。