有A、B、C、D、E和F六瓶无色溶液,它们都是中学化学中常用的无机试剂。纯E为无色油状液体,稀释时能放出大量热;B、C、D和F是盐溶液,且它们的阴离子均不同,现进行如下实验:
①A有刺激性气味,用蘸有浓盐酸的玻璃棒接近A时产生白烟;
②将A分别加入其它五种溶液中,只有D、F中有沉淀生成;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶解。根据上述实验信息,请回答下列问题:
⑴ 能确定的溶液是(写出溶液标号与相应溶质的化学式)
⑵ 不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法
【改编】碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g)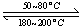 Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
| A.升高温度,正反应速率和逆反应速率都增大,平衡向右移动 |
B.缩小容器容积,平衡右移, H不变 H不变 |
| C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低,化学平衡常数增大 |
| D.当气体平均摩尔质量或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+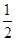 O2(g)=CO(g)
O2(g)=CO(g) H=-Q1 kJ
H=-Q1 kJ mol-1
mol-1
C(s)+ O2(g)=CO2(g) H=-Q2 kJ
H=-Q2 kJ mol-1
mol-1
S(s)+O2(g)=SO2(g) H=-Q3 kJ
H=-Q3 kJ mol-1
mol-1
则SO2与CO反应生成S的热化学方程式为: 。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时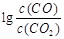 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。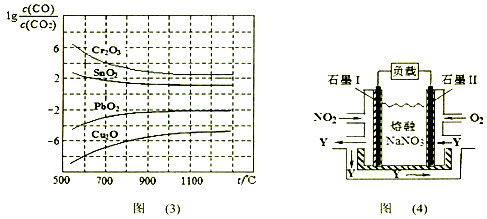
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,石墨II的电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上转移电子 mol。
【改编】(12分)【物质结构与性质】A、B、C、D、E、F都是元素周期表中前20号元素,其原子序数依次增大。B、C、D、E同周期,A、E同主族,F和其它元素既不在同周期也不在同主族。B、D、E的最高价氧化物的水化物均能互相反应生成盐和水,E的原子半径是同周期原子中最小的。
根据以上信息,回答下列问题:
(1)上述B、C、D、E四种元素中第一电离能由小到大的顺序是 ,电负性由大到小的顺序是 ,A、B、D、E离子半径由小到大的顺序为 (填相关元素或离子的符号)。
(2)A和E的氢化物中,沸点较高的是 (填相关物质的分子式);其原因是 。
(3)A和F可形成离子化合物,其晶胞结构如图所示:则每个晶胞中含阳离子的数目为 ,含阴离子的数目为 ,该离子化合物的化学式为 。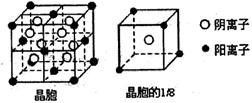
【化学与技术】硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸。
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为 ,
该反应在 中进行(填设备名称)。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用了多层催化剂且有热交换器的 (填设备名称)中进行反应。在如图所示的装置中,C处流出的气体有 ;SO3进入 (填设备名称)用____ 吸收,得到浓硫酸或发烟硫酸。
(3)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最
合适的生产条件是 。
(4)吸收塔排出的尾气中SO2的含量如果超过500 L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式 。
L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式 。
对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g) H=+180.5kJ·mol-1;
H=+180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) H =-483.6 kJ·mol-1;
H =-483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g) H =-92.4 kJ·mol-1。
H =-92.4 kJ·mol-1。
则氨的催化氧化反应的热化学方程式为 。
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g) H<0。
H<0。
一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。
①NO的平衡转化率为 ,0~20min平均反应速率v(NO)为 。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将 移动(填“向左”、“向右”或“不”)。
②若只改变某一反应条件X,反应由原平衡I达到新平衡II,变量Y的变化趋势如下图所示。下列说法正确的是 (填字母代号)。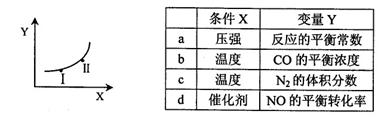
(3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。
a.放电过程中,电解质溶液的pH保持不变
b.溶液中的NH4Cl浓度增大,但Cl-离子浓度不变
c.每转移6.02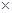 1023个电子,则有标准状况下11.2L电极反应物被氧化
1023个电子,则有标准状况下11.2L电极反应物被氧化
d.为保持放电效果,电池使用一段时间需更换电解质溶液
【改编】(18分)能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下前实现如下变废为宝的过程:
mCeO2 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述过程的总反应平衡常数表达式为 。该反应能量转化方式为 。
(2)CH3OH、O2和KOH溶液构成的燃料电池的负极电极反应式为 。该电池反应可获得K2CO3溶液,某温度下0.5mol L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。
①电解过程中发生反应的离子方程式是 ,阴极附近溶液PH (填“不变”、“升高”或“下降”)。
②如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,证明SO42‾已经完全沉淀的方法是 。
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式 。
③图中氢氧化钠溶液的质量分数a% b%(填“>”、‘‘=”或“<”),,燃料电池中正极上发生的电极反应为 。