【化学与技术】硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸。
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为 ,
该反应在 中进行(填设备名称)。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用了多层催化剂且有热交换器的 (填设备名称)中进行反应。在如图所示的装置中,C处流出的气体有 ;SO3进入 (填设备名称)用____ 吸收,得到浓硫酸或发烟硫酸。

(3)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最
合适的生产条件是 。

(4)吸收塔排出的尾气中SO2的含量如果超过500 L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式 。
L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式 。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| A |
B |
C |
D |
||||||||||||||
| E |
F |
G |
H |
I |
|||||||||||||
| J |
K |
M |
|||||||||||||||
| L |
|||||||||||||||||
试回答下列问题:
(1)写出基态时J的电子排布式,L的原子序数为,M的简化电子排布式。
(2)下列关于元素在元素周期表中的位置的叙述正确的是。
A.K位于元素周期表中第四周期、ⅡB族,属于ds区元素;
B.J位于元素周期表中第四周期、ⅣB族,属于d区元素;
C.F位于元素周期表中第三周期、ⅡA族,属于s区元素;
D.I位于元素周期表中第三周期、ⅦA族,属于ds区元素;
(3)下列有关说法正确的是。
A.第一电离能G>F>E; B.电负性D>C;
C.原子半径E>B D.最高价含氧酸的酸性I>H
(4)根据对角线规则及已知元素性质,回答下列问题:
①B元素最高价氧化物的水化物与E元素最高价氧化物的水化物的溶液反应的离子方程
式。
②A元素的单质与氧气在点燃时的化学反应方程式。
(5)下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。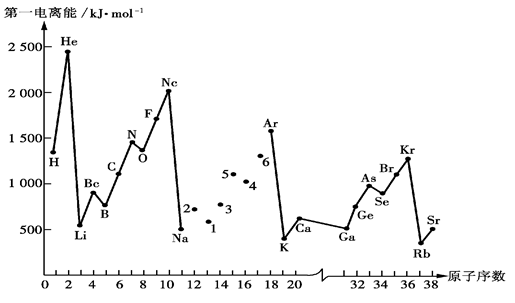
① 认真分析下图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
② 从下图分析可知,同一主族元素原子的第一电离能I1变化规律是
___________________________________________________________________________;
Zn的第一电离能大于Ga的原因是
。
③上图中5号元素在周期表中的位置是____________________________;
(8分)现有HNO3和NaNO3的混合溶液200mL,其中 HNO3和NaNO3的物质的量浓度均为1 mol/L。若要使 HNO3和NaNO3的物质的量浓度分别为2 mol/L 和0.2 mol/L,应加入63%的浓硝酸(密度为1.2g/cm3)________mL,再加入蒸馏水稀释至_______mL才能实现。
(12分)实验室配制460mL0.100mol/LNa2CO3溶液回答下列问题,现有下列仪器
A 烧杯 B 100mL量筒 C 100mL容量瓶 D药匙E.玻璃棒 F.托盘天平
(1)配制时,必须使用的仪器有___________(填代号),还缺少的仪器是_______________。该试验中两次用到玻璃棒,其作用分别是___________________,_________________。
(2)应用托盘天平称取Na2CO3·10H2O晶体的质量为_________,若加蒸馏水不慎超过刻度线,处理的方法是______________。
(3)若实验遇下列情况,溶液的浓度偏高的是()
A溶解后没有冷却便进行定容
B摇匀后发现液面低于刻度线,滴加蒸馏水至刻度线再摇匀
C定容时俯视容量瓶的刻度线
D.容量瓶内壁附有水珠而未干燥处理
F.称取的Na2CO3·10H2O晶体失去了部分结晶水
(4)若取50.0mL上述已配好的溶液,与另一150mL0.200mol/L的Na2CO3溶液混合,最后得到的溶液的物质的量浓度为_________________(设溶液的体积变化可忽略)。
(12分)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下: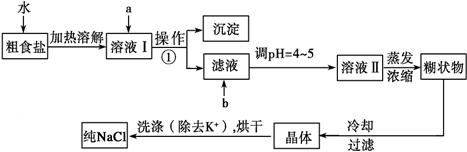
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳、稀盐酸。
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO ,选出a所代表的试剂,按滴加顺序依次为____________________ (只填化学式)。
,选出a所代表的试剂,按滴加顺序依次为____________________ (只填化学式)。
(2)如何检验 SO 是否沉淀完全。
是否沉淀完全。
(3)调节pH 的目的,试剂b是(填名称)。
(4)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________,使用该试剂的目的是。
(10分)某溶液中可能含有下列6种离子中的某几种:Cl-、SO 、NH4+、CO
、NH4+、CO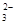 、K+、Na+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。
、K+、Na+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。
(1)溶液一定存在的离子有,可能存在的离子有。
(2)原溶液中c(CO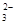 )为,c(NH4+)c(SO
)为,c(NH4+)c(SO ) (填“>、<或=”)。
) (填“>、<或=”)。
(3)如果上述6种离子都存在,则c(Cl-)c(SO ) (填“>、<或=”)。
) (填“>、<或=”)。