A、B、C、D、E、F为原子序数依次增大的短周期元素,G为第四周期元素,B、C相邻且同周期,A、D同主族。A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。E是地壳中含量最多的金属元素。F元素为同周期电负性最大的元素。D和F可形成化合物丙,E和F可形成化合物丁。G为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出G基态原子的电子排布式
(2)B和C比较,第一电离能较大的元素是 (填元素符号),其原因为
(3)A与B形成的化合物易溶于化合物甲,其主要原因是
(4)甲、乙两分子中含有非极性共价键的是 (填分子式),它中心原子的杂化方式是
(5)已知化合物丁熔点190℃,沸点183℃,结构如右图所示。

①丙和丁比较,熔点较低的化合物是 (填化学式),其原因为
②则丁含有的作用力有 (填序号)。
A.离子键 B.共价键 C.金属键
D.配位键 E.范德华力
阿扎西隆(azasetron)适用于治疗由服用药物引起的恶心、呕吐等消化道症状。文献资料显示,它可由水杨酸甲酯(a)为原料合成,部分合成路线如下: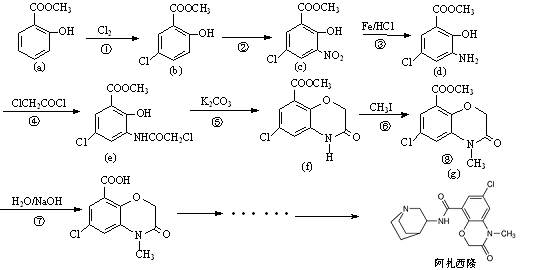
试回答下列问题:
(1)填写反应类型:反应③、反应④;
(2)反应②的试剂是:;
(3)水杨酸甲酯(a)的同分异构体中,能与碳酸氢钠溶液放出二氧化碳,再加入氯化铁溶液又显紫色有多种,写出其中一种的结构简式;
(4)水杨酸甲酯是水杨酸(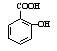 )与甲醇形成的酯,请写出该反应的化学方程式。
)与甲醇形成的酯,请写出该反应的化学方程式。
(1)质量都为3 g的镁和铝,物质的量之比为;将它们分别放入适量的盐酸溶液中恰好完全反应,则消耗的盐酸的物质的量之比为。
(2)在50 mL NaNO3和Na2SO4的混合溶液中,c (Na+) =" 1" mol/L,往其中加入50 mL BaCl2溶液恰好完全反应,后得到2.33 g白色沉淀,则原混合溶液中c (NO3-)=mol/L。
(3)已知Cu3P中P为 -3价,在反应 11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,①被氧化的P和被还原的P的物质的量之比为;
②当有8 molH2O参加反应,上述反应转移的电子数目约为个;
③上述反应中7.5 mol CuSO4氧化的P原子的物质的量为。
在四个无标签的试剂瓶中,分别盛有盐酸、Ba(OH)2 溶液、Na2CO3溶液、AgNO3
溶液。为了确定各瓶试剂,将它们分别编号为A、B、C、D,分别取样两两混合,其实验现象为:
A+B→无色气体 B+C→白色沉淀 A+D→白色沉淀 A+C→无明显现象
(1)由此推断各试剂瓶中所盛试剂为(填化学式)
A:B:C:D:
(2)写出下列反应的离子方程式
①A+C:
②A+D:
某次实验需用480 mL、0.5 mol/L 的稀H2SO4溶液,某同学用98%的浓H2SO4 (ρ="1.84" g/cm3)进行配制,请回答下列问题:
(1)98%的浓H2SO4(ρ="1.84" g/cm3)的物质的量浓度为
(2)将下列步骤中的空格内将所用仪器补充填写完整
①用20 mL量筒量取所需的浓硫酸
②将烧杯中的溶液转移到mL的容量瓶中
③将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
④将溶液冷却,恢复室温
⑤向容量瓶中加入蒸馏水,在距离刻度1~2 cm时,改用加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦洗涤烧杯2~3次,洗涤液也注入容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
(3)实验中上述步骤的正确顺序为(填序号)。
(4)在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”)。
①所用的浓硫酸长时间放置在密封不好的容器中
②量取浓硫酸所用量筒有蒸馏水
③定容时,俯视液面
某氯化钠样品中含有少量的硫酸钠和碳酸钠杂质,按下列流程进行净化,回答下列问题。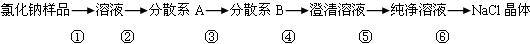
(1)分散系A、B都属于(选填“溶液”“胶体”或“浊液”)。
(2)写出以下步骤所需的试剂(用化学式表示)
②③⑤
(3)写出以下步骤的实验操作名称①④⑥
(4)第④步中要用到的玻璃仪器有烧杯、、
(5)写出第②步有关反应的离子方程式