(1)Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元 素 |
Mn |
Fe |
|
| 电离能/kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
回答下列问题:Mn元素价电子层的电子排布式为 ,比较两元素的I2.I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是
(2)白色的无水硫酸铜粉末溶于水得到蓝色溶液,请解释这一现象的原因(用离子方程式) ,向蓝色溶液中加入氨水,首先形成蓝色沉淀,继续加入氨水,沉淀溶解得到深蓝色透明溶液,请写出沉淀溶解过程的离子方程式 。
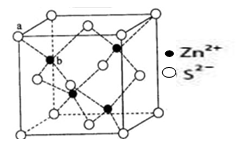
(3)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。晶体结构如下图所示,其晶胞边长为540.0 pm,晶胞中Zn原子的配位数为 ,列式表示并计算立方ZnS晶体的密度(g·cm-3) 。
某课题组以苯为主要原料,采取以下路线合成利胆药——柳胺酚。
柳胺酚
已知:
回答下列问题:
(1)对于柳胺酚,下列说法正确的是
| A.1 mol柳胺酚最多可以和2 molNaOH反应 | B.不发生硝化反应 |
| C.可发生水解反应 | D.可与溴发生取代反应 |
(2)写出 反应所需的试剂______________。
反应所需的试剂______________。
(3)写出 的化学方程式____________________________。
的化学方程式____________________________。
(4)写出化合物F的结构简式_____________________________。
(5)写出同时符合下列条件的F的同分异构体的结构简式____________(写出3种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子; ②能发生银镜反应
(6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图:
2—丁烯是石油裂解的产物之一,回答下列问题:
(1)在催化剂作用下,2—丁烯与氢气反应的化学方程式为 ,反应类型为 。
(2)烯烃A是2—丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为 ;A分子中能够共平面的碳原子个数为 ,A与溴的四氯化碳溶液反应的化学方程式为 。
【化学——选修3:物质结构与性质】
E、G、M、Q、T是五种原子序数依次增大的前四周期元素。E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)与T同区、同周期元素原子价电子排布式是 。
(2)E、G、M均可与氢元素形成氢化物,它们的最简单氢化物在固态时都形成分子晶体,其中晶胞结构与干冰不一样的是 (填分子式)。
(3)E、G、M的最简单氢化物中,键角由大到小的顺序为 (用分子式表示),其中G的最简单氢化物的VSEPR模型名称为 ,M的最简单氢化物的分子立体构型名称为 。
(4)EM、GM+、G2互为等电子体,EM的结构式为(若有配位键,请用“→”表示) 。E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因 。
(5)TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如下图所示,该晶体的密度为ρ g·cm-3。如果TQ的摩尔质量为M g/mol,阿伏加德罗常数为NA mol-1,则a、b之间的距离为 cm。
【化学——选修2:化学与技术】
工业上以Al(OH)3、H2SO4、(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如图所示:
回答下列问题:
(1)氧化步骤中发生的主要反应的离子方程式为 。
(2)已知:25℃时,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O NH3·H2O+H+,则该反应的平衡常数为 。
NH3·H2O+H+,则该反应的平衡常数为 。
(3)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为 。
(4)固体NH4Al(SO4)2·12H2O在加热时,固体残留率随温度的变化如图所示。633℃时剩余固体的成分为 。
(5)综上分析,流程图中M混合气体的主要成分的化学式为 。M可用一种物质吸收以实现循环利用,该物质的名称是 。
下图所示的四个容器中分别盛有不同的溶液,除a、b外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4 2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同;据此回答:
2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同;据此回答:
(1)a电极的电极材料是 (填“PbO2”或“Pb”)。
(2)丙装置中发生电解的总反应方程式为 。
(3)电解20min时,停止电解,此时要使乙中溶液恢复到原来的状态,需要加入的物质及其物质的量
是 。
(4)20min后将乙装置与其他装置断开,然后在c、d两极间连接上灵敏电流计,发现电流计指针偏转,则此时c电极为 极,d电极上发生反应的电极反应式为 。
(5)电解后取a mL丁装置中的溶液,向其中逐滴加入等物质的量浓度的CH3COOH溶液,当加入b mL CH3COOH溶液时,混合溶液的pH恰好等于7(体积变化忽略不计)。已知CH3COOH的电离平衡常数为1.75×10-5,则a/b = 。